Нервно-мышечный синапс — Википедия
Нервно-мышечный синапс (также нейромышечный, либо мионевральный синапс) — эффекторное нервное окончание на скелетном мышечном волокне. Входит в состав нервно-мышечного веретена. Нейромедиатором в этом синапсе является ацетилхолин.
В этом синапсе нервный импульс превращается в механическое движение мышечной ткани.
Нервный отросток подходя к сарколемме мышечного волокна утрачивает миелиновую оболочку и образует сложный аппарат с плазматической мембраной мышечного волокна, образующийся из выпячиваний аксона и цитолеммы мышечного волокна, создавая глубокие «карманы». Синаптическая мембрана аксона и постсинаптическая мембрана мышечного волокна разделены синаптической щелью. В этой области мышечное волокно не имеет поперечной исчерченности, характерно скопление митохондрий и ядер. Терминали аксонов содержат большое количество митохондрий и синаптических пузырьков с медиатором ацетилхолином.
Морфология синапса в гладкомышечной ткани[править | править код]
Двигательные нервные окончания в гладкой мышечной ткани построены проще — безмиелиновые пучки аксонов проникают между глиоцитами к пласту гладких мышц и образуют булавовидные расширения, которые содержат холинергические и адренергические пузырьки.
Нервно-мышечные заболевания
Заболевания периферических нервов
Нейромышечный синапс
Миопатии
Клинические синдромы
Заболевания периферических нервов
Определения
Мононейропатия. Изолированное поражение периферических нервов, например, при сдавлении, травме, нарушении кровоснабжения (поражение vasa vasorum).
Системные заболевания, поражающие нервы, чувствительные к сдавлению, например сахарный диабет, или патологические состояния, вызывающие диффузные нарушения сосудистого русла (васкулиты), способны вызывать мультифокальную нейропатию (или множественную полинейронатию).
Полинейропатия. Одновременное множественные поражение периферических нервов вследствие воспалительных процессов, метаболических нарушений или токсических воздействий. Клинически проявляется диффузным, симметричным поражением периферических нервов. В первую очередь страдают дистальные отделы конечностей, причем нижние конечности поражаются раньше верхних.
Мононейропатии
Наиболее часто встречаются следующие мононейропатии.
Синдром запястного канала
Компрессия срединного нерва в области запястья при его прохождении через канал может произойти:
- изолированно; например, у пациентов с избыточными физическим нагрузками (связанными с характером трудовой деятельности)
- при заболеваниях, характеризующихся повышенной чувствительностью нервных стволов к внешнему воздействию (сдавлению)
- при сдавлении нервного ствола в области запястного канала гипертрофированными тканями (табл. 1).
Таблица 1. Состояния, ассоциированные с синдромом запястного канала
|
Беременность Сахарный диабет Локальные деформации вследствие остеоартрита, переломов костей Микседема Акромегалия Амилоидоз |
Клинические проявления синдрома запястного капала:
- боль в кисти или предплечье, особенно ночью или при напряжении
- парез (паралич) и гипотрофия мышц возвышения большого пальца (thenar)
- снижение чувствительности в зоне иннервации срединного нерва (рис. 1)
- парестезии по ходу срединного нерва, которые возникают при постукивании в области запястного канала (симптом Тинеля)
- как правило, двустороннее поражение.

Рис. 1. Распределение зон иннервации срединного, локтевого и лучевого нервов на поверхности плеча и предплечья
Диагноз может быть подтвержден при помощи электрофизиологических исследований. Определение содержания в крови глюкозы, гормонов щитовидной железы, СОЭ, могут помочь в установлении правильного диагноза.
Лечение определяется тяжестью состояния больного. Основные лечебные мероприятия:
- фиксация мышц, особенно ночью, в частично вытянутом состоянии, кисть должна при этом находиться в состоянии разгибания
- мочегонные средства — эффект неясен
- введение кортикостероидов в просвет запястного канала
- хирургическая декомпрессия срединного нерва.
Нейропатия локтевого нерва
Локтевой нерв может быть подвержен сдавлению на различном уровне, однако наиболее часто это случается в области локтевого сустава.
Клинические проявления:
- боли и/или парестезии (покалывающего характера), распространяющиеся от локтя вниз по локтевой поверхности к предплечью
- паралич или слабость внутренних мышц кисти (поражение мышц возвышения большого пальца)
- снижение чувствительности в зоне иннервации локтевого нерва (рис. 1)
- при хроническом поражении формируется когтистая кисть.
Определение скорости проведения импульса при помощи электронейрографического исследования позволяет точно установить локализацию поражения локтевого нерва.
При нетяжелом поражении может быть эффективна фиксация руки на ночь, выпрямленной в локтевом суставе, что обеспечивает уменьшение сдавления нервного ствола. При более тяжелом поражении положительный результат обеспечивает хирургическая декомпрессия или
Парез лучевого нерва
Сдавление лучевого нерва в верхней части предплечья может привести к острому развитию синдрома «свисающей кисти», при этом иногда наблюдается утрата чувствительности в зоне иннервации лучевого нерва (рис. 1). Как правило, данное поражение является следствием длительного пребывания предплечья в непривычном положении, например при свисающей в неудобном положении руке с поручня кресла при алкогольном опьянении (
Парез плечевого сплетения
Помимо острой травмы плечевого сплетения (например, в результате родовой травмы или дорожно-транспортного происшествия у мотоциклистов) поражение плечевого сплетения может быть обусловлено другими причинами. Поражение верхнего отдела сплетения носит название паралича Эрба, а нижнего — паралича Клюмпке.
Добавочное ребро
Добавочное ребро или гипертрофированная соединительная ткань может быть причиной компрессии плечевого сплетения в области верхней апертуры грудной клетки. На определенном этапе развития неврологии и нейрохирургии имела место гипердиагностика данного состояния и, как следствие, высокая частота необоснованных хирургических вмешательств. На сегодняшний день считается, что оперативное вмешательство показано пациентам с нарастающим парезом внутренних мышц предплечья, выраженной утратой чувствительности (по ходу локтевого нерва) и с диагнозом, подтвержденным электрофизиологическими методами обследования. Визуализация плечевого сплетения при помощи МРТ обычно неэффективна. При рентгенографическом обследовании возможно выявление добавочного ребра, но сдавление нервного ствола фиброзной тканью визуализировать не удается.
Опухоль Пенкоста
Бронхогенная карцинома верхушки легкого может прорастать в нижние корешки плечевого сплетения, вызывая усиливающуюся боль в одноименной руке, дистальный паралич и гипотрофию, а также снижение чувствительности в дерматомах С7, С8 и Th20. Возможен также синдром Горнера вследствие поражения преганглионарных вегетативных волокон. Симптоматика имеет сходство с первичными и метастатическими опухолями.
Диагностические трудности возникают при поражении сплетения у больных с карциномой молочной железы после проведенного курса лучевой терапии, так как неврологический дефицит может быть следствием распространения опухоли или
Идиопатическая плечевая плексопатия (невралгическая амиотрофия или нейропатия плечевого нерва)
Состояние характеризуется острой болью в плече и предплечье. Очевидных причин этому нет, хотя заболевание может возникнуть после прививки или операции. После регресса болей (через несколько дней или недель) появляется частичный паралич и слабость окололопаточной группы мышц, а также более удаленных мышечных групп верхней конечности. Особенно подвержена поражению передняя лестничная мышца, атрофия которой сопровождается развитием крыловидных лопаток (рис. 2). Поражение, как правило, одностороннее, с минимальными чувствительными нарушениями. Электрофизиологические исследования зачастую малоэффективны, хотя могут выявляться признаки денервации пораженных мышц. Состав СМЖ не изменен. Специфического лечения не существует, у большинства больных через 1,5-2 года наступает спонтанное выздоровление.

Рис. 2. Крыловидные лопатки
Парестетическая мералгия
Компрессия латерального кожного нерва бедра, проходящего под паховой связкой; характеризуется потерей чувствительности в соответствующей области (рис. 3). Начало заболевания связано, в частности, с изменением веса пациента (увеличение или уменьшение).

Рис. 3. Парестетическая мералгия. Схема распределения нарушений чувствительности при поражении латерального кожного бедренного нерва
Латеральный подколенный паралич
Подколенный нерв подвержен компрессионным повреждениям в области, где он огибает шейку малоберцовой кости. Проявляется синдромом свисающей стопы (вследствие пареза разгибателя стопы). Одновременно появляются слабость при тыльном разгибании и отведении стопы с утратой чувствительности разной степени выраженности. Данное состояние часто встречается у иммобилизованных пациентов и у пациентов с повышенной чувствительностью нервных стволов к сдавлению, например при сахарном диабете. Свисающая стопа может быть следствием поражения поясничного корешка (обычно L5). Следует отличать данный синдром от поражения малоберцового нерва, для которого характерна сохранная внутренняя ротация стопы, так как задняя большеберцовая мышца иннервируется большеберцовым нервом, а не малоберцовым. Однако требуется электрофизиологическое исследование для уточнения локализации поражения нерва. Повреждение малоберцового нерва обычно обратимо, так как вызывается нарушением проводимости (нейрапраксия). Положительный эффект оказывает фиксация стопы лонгетой.
Мультифокальная нейропатия
Причины мультифокальной нейропатии (множественный мононеврит):
- злокачественная инфильтрация (карцинома или лимфома)
- васкулит или заболевание соединительной ткани:
- ревматоидный артрит
- системная красная волчанка
- узелковый периартрит
- гранулематоз Вегенера;
- саркоидоз
- диабет
- инфекционные заболевания:
- проказа
- опоясывающий герпес
- ВИЧ
- болезнь Лайма;
- наследственная нейропатия со склонностью к параличам от сдав-ления.
Наиболее частой причиной мультифокальной нейропатии является васкулит с болями, слабостью и гипестезией в зонах иннервации нескольких периферических нервов. Чаще поражаются нижние конечности. Поражения отдельных нервов постепенно накапливаются, проявляясь асимметричным поражение конечностей.
Полинейропатии
Диффузное поражение периферических нервов может быть разделено на группы с поражением двигательных, чувствительных или смешанных нервов. Существует патофизиологическая классификация полинейропатии, основным критерием которой является преобладание поражения миелиновой оболочки или непосредственно нервного ствола нерва (демнелинизирующая или аксональная нейропатия соответственно). Причины полинейропатии приведены в табл. 2.
Таблица 2. Причины полинейропатии
|
Наследственная предрасположенность Инфекционные заболевания Проказа Дифтерия ВИЧ Болезнь Лайма Воспалительные процессы Синдром Гийена-Барре Хроническая воспалительная демиелинизирующая полинейропатия Саркоидоз Синдром Шегрена Васкулиты (например, волчанка, полиартериит) Новообразования Паранеопластические процессы Парапротеинемические процессы Метаболические расстройства Диабет Уремия Микседема Отложения амилоида Неправильное питание Дефицит витаминов, в особенности тиамина, ниацина и витамина В12 Отравления Например, алкоголем, свинцом, мышьяком, золотом, ртутью, таллием, инсектицидами, гексаном Лекарственные препараты Например, изониазид, винкристин, цисплатин, метронидазол, нитрофураны, фенитоин, амиодарон |
У пациентов могут развиться онемение и/или парез дистальных отделов конечностей. Двигательные нарушения характеризуются вялыми парезами и мышечными атрофиями. Длительно развивающиеся нейропатии могут привести к деформации стоп и кистей рук (полая стопа — рис. 4 и когтистая кисть соответственно). Тяжелое поражение сенсорных волокон может сопровождаться развитием нейропатических язв и деформаций суставов (рис. 5). Возможны сопутствующие вегетативные расстройства. Клинические признаки такие же, как и при распространенном поражении периферических мотонейронов с вялыми параличами, гипотонией и снижением сухожильных рефлексов. Утрата проприоцептивной чувствительности в дистальных отделах конечностей может сопровождаться сенсорной атаксией. Характерно снижение болевой, температурной и тактильной чувствительности но типу «носков и перчаток». В ряде случаев можно обнаружить утолщение периферических нервов. Тактика обследования пациентов с полинейропатиями приведена в табл. 3.

Рис. 4. Полая стопа

Рис. 5. Нейропатия правой лодыжки (слева) и ступни (справа; артропатия Шарко)
Таблица 3. Обследование больного с нейропатией
|
Исследование крови Клинический анализ с подсчетом форменных элементов, СОЭ, содержание глюкозы, электролитов, мочевины, печеночных ферментов и гормонов щитовидной железы, витамина В12, электрофорез сывороточных белков, определение аутоантител Исследование мочи Микроскопический анализ для подтверждения васкулита, определение содержания глюкозы, порфиринов, белка Бена-Джонса Исследование СМЖ Повышенное содержание белка, в частности при воспалительных нейропатиях Нейрофизиологическое обследование Изучение скорости проведения по двигательным и чувствительным нервам и ЭМГ Рентгенография органов грудной клетки Для исключения саркоидоза, карциномы Специальные обследования для отдельных пациентов Биопсия периферических нервных волокон при неизвестном характере нейропатии и ухудшении состояния больного. Проводится для подтверждения наличия васкулита, проказы и хронической воспалительной демиелинизирующей полинейропатии. Биопсия костного мозга, обследование скелета при подозрении на миеломную болезнь. При определенных состояниях — специфические анализы крови, например при наследственных нейропатиях — анализ ДНК, при врожденных нарушениях метаболизма — обнаружение ферментов из лейкоцитов, при болезни Лайма — обнаружение антител к боррелии. |
Лечение больных с полинейропатиями определяется в первую очередь причинами заболевания. Пациенты с воспалительными полинейропатиями требуют госпитализации в специализированные отделения. Больному с острой воспалительной демиелинизирующей полинейропатией (синдром Гийена-Барре) может потребоваться реанимационная помощь. Хроническая воспалительная демнелинизирующая полинейропатия (ХВДП) и полиневропатия при васкулитах требуют применения кортикостероидов и/или иммуномодулирующих препаратов, включая иммуносупрессоры (азатиоприн, циклофосфамид или циклоспорин), внутривенное введение иммуноглобулина или плазмаферез. Симптоматическое лечение позволяет снизить вероятность осложнений, включая нарушения вегетативных функций и болевые синдромы.
Важно отличать синдром Гийена-Барре и ХВПД — демиелини-зирующие заболевания периферических нервов от демиелинизации ЦНС (табл. 17.4).
Таблица 4. Заболевания, приводящие к демиелинизации. Классификация в соответствии с локализацией основного очага поражения и характером течения заболевания
|
|
Центральная нервная система |
Периферическая нервная система |
|
Острые |
Острый рассеянный энцефаломиелит (ОРЭМ) — редко |
Синдром Гийена-Барре — достаточно часто |
|
Хронические |
Рассеянный склероз —часто |
Хроническая воспалительная демиелинизирующая полинейропатия (ХВДП) — редко |
Нейромышечный синапс
Миастения
Аутоиммунное заболевание, при котором у большинства пациентов выявляются циркулирующие антитела к ацетилхолиновым рецепторам нейромышечных синапсов (рис. 6). В качестве причины возможна патология тимуса (гиперплазия, атрофия или опухоль — тимома). Данное заболевание встречается относительно редко, в среднем в год регистрируется 0,4 случая на 100 000, но так как большинство пациентов выживает, то количество заболевших достигает 1 на 10 000. Подвержены все возрастные группы.

Рис. 6. Нервномышечный синапс
Клинические проявления
- Птоз
- Диплопия с ограничением движения глазных яблок
- Слабость мимических мышц
- «Голос миастеника»
- Слабость при закрывании глаз
- Бульбарные нарушения:
- дисфагия (с попаданием пищи в носовые ходы)
- дизартрия (с носовым оттенком)
- Вовлечение дыхательных мышц (острые бульбарные и дыхательные расстройства, вызванные миастенией, требуют неотложной помощи)
- Слабость мышц шеи и конечностей, усиливающаяся к концу дня и после нагрузок («патологическая утомляемость»).
Обследование
- Определение содержания антител к ацетилхолиновым рецепторам в сыворотке крови (у 15% пациентов результат анализа отрицательный).
- Проба с введением антихолинэстеразных препаратов: преходящее и быстро нарастающее улучшение состояния после внутривенного введения эдрофониума (антихолинэстеразный препарат короткого действия, блокирует катаболизм ацетилхолина, временно повышая его содержание). (В Российской Федерации используется тест с прозерином). Тест более эффективен при использовании метода двойного контрольного исследования. Ввиду возможных холиномиметических эффектов вследствие повышения уровня ацетилхолина следует обеспечить возможность экстренного введения атропина и проведения реанимационных мероприятий.
- ЭМГ, включая игольчатое исследование с отведением потенциала от отдельных волокон.
- Исследование функции щитовидной железы при сопутствующем тиреотоксикозе.
- У пациентов с тимомой выявляются антитела в тканях поперечнополосатых мышц.
- КТ переднего средостения для выявления гиперплазии тимуса.
Лечение
- Антихолинэстеразные препараты, например пиридостигмин, в качестве симптоматического лечения. Пациентам требуется постоянное увеличение дозировок препаратов, что может привести к развитию холиномиметических побочных эффектов с повышением слюноотделения, рвотой, болью в эпигастрии и диареей. В редких случаях возможно развитие холинергического криза
- Кортикостероиды (преднизолон) назначаются при заболевании средней тяжести, не поддающемуся другому лечению. Лечение начинается с низких дозировок с постепенным увеличением дозы, препарат применяют через день. В начале лечения возможно нарастание симптоматики. Стационарное лечение показано в начале применения кортикостероидов у пациентов с генерализованными формами заболевания. По мере наступления эффекта доза может быть снижена в соответствии с клинической картиной.
- Иммуносупрессоры (азатиоприн) используются в комбинации с кортикостероидами при заболевании средней тяжести.
- Тимэктомия показана при тимоме и у молодых пациентов на ранних стадиях заболевания для уменьшения потребности в лекарственной терапии и реже — для достижения полной ремиссии.
- Плазмаферез или внутривенное введение иммуноглобулина как средства подготовки к тимэктомии и при тяжелых формах заболевания.
Пациентам с миастенией следует избегать приема некоторых антибиотиков, таких как аминогликозиды, вследствие их блокирующего эффекта на уровне нейромышечного синапса.
Другие миастенические синдромы
Реже нейромышечный синапс может страдать в результате наследственного заболевания или вследствие наранеопластического процесса (миастенический синдром Ламберта-Итона).
Миопатии
Основные причины развития миопатий приведены в табл. 5. Клинически миопатия проявляется слабостью мышц туловища и проксимальных отделов конечностей. Возможны слабость мимических мышц и мускулатуры шеи, выявляемая при сгибании и/или разгибании. Походка становится неустойчивой. При приобретенном характере заболевания мышечная слабость может быть относительно умеренной, по крайней мере на ранних стадиях, а сухожильные рефлексы на протяжении длительного времени остаются сохранными.
Таблица 5. Причины возникновения миопатий
|
Наследственные факторы Мышечная дистрофия Метаболические миопатий Инфекционные заболевания Газовая гангрена Стафилококковый миозит Вирусная инфекция (вирусы гриппа, Коксаки, ЕСНО) Паразиты (цистицеркоз, трихинеллез) Воспалительные процессы Полимиозит Дерматомиозит Саркоидоз Новообразования
Дерматомиозит — может быть следствием паранеопластического процесса Метаболические (приобретенные) расстройства Тиреотоксикоз Синдром Кушинга Остеомаляция Токсикоз (от приема лекарственных препаратов) Кортикостероиды Галотан — злокачественная гипертермия (редко) Другие лекарственные препараты |
Обследование больного с миопатией:
- анализ крови:
- СОЭ, аутоантитела (при приобретенных заболеваниях)
- креатинкиназа — уровень резко повышен вследствие высвобождения из поврежденных мышечных клеток
- ЭМГ
- биопсия мышц.
Клинические синдромы
Мышечные дистрофии
Дистрофинопатии
Заболевание обусловлено мутацией гена, связанного с Х-хромосомой и отвечающего за синтез мышечного белка дистрофина. Встречается у детей, подростков и у взрослых. Детская форма (мышечная дистрофия Дюшена) протекает наиболее тяжело. У заболевших мальчиков уже в раннем детстве развивается слабость в проксимальных отделах конечностей. Характерным признаком является взбирание «лесенкой» (симптом Говерса). Мышцы голеней могут казаться гипертрофированными (рис. 7) из-за замещения мышечных волокон соединительной тканью (псевдогипертрофия). Дети обычно прикованы к креслу-каталке до подросткового возраста. Болезнь неуклонно прогрессирует, смерть наступает от сердечных или дыхательных осложнений в возрасте до 20 лет. Менее тяжелое течение наблюдается при дебюте заболевания в подростковом или взрослом возрасте (мышечная дистрофия Беккера). Заболевание, как правило, не носит угрожающего для жизни характера, однако зачастую сопряжено с прогрессирующей инвалидизацией. В настоящее время имеется возможность диагностики миодистрофий при помощи молекулярного анализа гена дистрофина.

Рис. 7. Псевдогипертрофия голеней
Другие мышечные дистрофии
Миотоническая дистрофия — заболевание с аутосомно-доминант-ным типом наследования, при котором у пациентов присутствует аномально длительное напряжение мышц (миотония). Проявляется невозможностью расслабления мышцы. Характерным признаком является перкуссионная миотония, которая выявляется постукиванием молоточком по мышце. Миотония может быть диагностирована при электромиографическом обследовании.
Типичные симптомы:
- двусторонний птоз
- слабость лицевых мышц
- паралич и слабость грудино-ключично-сосцевидных мышц
- ранняя катаракта
- сопутствующие эндокринные нарушения (сахарный диабет, облысение и атрофия яичек).
В качестве терапии при миотонии могут применяться фенитоин или мексилетин. При наследственной миотонии наблюдаются умеренно выраженные атрофия и слабость мышц.
Лице-лопаточно-плечевая мышечная дистрофия является аутосомно-доминантным заболеванием. У пациентов наблюдается двусторонняя слабость мимических мышц и крыловидное расположение лопаток. В дополнение к параличу и слабости проксимальных мышц верхних конечностей обычно имеются слабость мышц спины и тазового пояса, наблюдается неустойчивая походка и поясничный гиперлордоз. Реже при мышечных дистрофиях и врожденных миопатиях поражаются мышцы глазного яблока и глотки.
Другие наследственные заболевания
Метаболические нарушения, например гликогенозы, могут сопровождаться мышечной слабостью, нередко ассоциированной с миалгиями и спазмами.
При семейном периодическом параличе приступы выраженной мышечной слабости могут быть спровоцированы напряжением, употреблением пищи с высоким содержанием углеводов, длительным пребыванием на холоде. Заболевание может быть связано с гипо- и гиперкалиемией.
Приобретенные заболевания
Воспалительные миопатии
Полимиозит может развиваться как изолированно, гак и вместе с другими аутоиммунными поражениями соединительной ткани, например системным склерозом, фиброзирующим альвеолитом и синдромом ПТегрена.
Дерматомиозит является сопутствующим заболеванием при воспалительной миопатии с характерной фиолетовой (гелиотропной) сыпью на лице. Ярко-красная сыпь может быть локализована в области суставов, передней поверхности грудной клетки, поверхностях разгибателей. У некоторых пациентов с дерматомиозитом, в частности у мужчин старше 45 лет, нередко имеется злокачественное новообразование, например карцинома бронхов или желудка. —
Клинические проявления воспалительной миопатии такие же, как при проксимальной миопатии, однако могут также присутствовать дисфагия как результат вовлечения мышц глотки, мышечные боли и гиперестезия. Возможны также артралгия и феномен Рейно.
После гистологического подтверждения диагноза проводится лечение кортикостероидами и иммуносупрессорами (например, азатиоприн). Пациентам требуется наблюдение в течение нескольких лет, у многих остается мышечная слабость. Один из гистологически диагностируемых вариантов заболевания — миозит с включением телец — лечению не поддается. Данное состояние — довольно частая форма приобретенных мышечных заболеваний, поражающая в основном пожилых людей. Характерной особенностью является избирательное поражение сгибателей пальцев кистей и четырехглавых мышц. Недостаточный эффект применения иммуносупрессоров послужил основой гипотезы о вторичности воспалительных реакций по отношению к дегенеративным изменениям мышечной ткани.
Неврология для врачей общей практики. Л. Гинсберг
Опубликовал Константин Моканов
Нервно-мышечная физиология | Кафедра физиологии
Физиология нервов.
Центральная нервная система у человека состоит из нервных клеток, каждая из которых имеет один аксон и много дендритов. Нервные волокна делятся на: мякотные и безмякотные. Все они имеют шванновскую оболочку, а мякотные, кроме этого, покрыты еще миелиновой оболочкой между которой имеются перехваты Ранвье, в которых миелиновая оболочка отсутствует. Безмякотные волокна имееют малый диаметр, меньше 1,3 мкм, небольшую скорость распространения импульса до 2 м/сек, продолжительность ПД – 2 мсек. Мякотные возникли из безмякотных, диаметр до 25 мкм, скорость распространения возбуждения до 120 м/сек, продолжительность ПД – 0,4-0,5 мсек.
Распространение ПД по безмякотному волокну: немецкий физиолог Герман предложил теорию «местных токов», согласно которой при распространении возбуждения на мембране нервного волокна между возбужденным и невозбужденным участком возникает местный ток, который является раздражителем для невозбужденного участка. Если его величина достаточна для возникновения ПД в соседнем участке, то ПД распространяется на этот участок.
Распространение местных токов в безмякотных нервных волокнах прямопропорционально сопротивлению мембраны и обратнопропорционально сопротивлению внутри- и внеклеточной среды. Расстояние на которое распространяются местные токи будет тем больше, чем больше амплитуда ПД и чем меньше пороговый потенциал.
В мякотных волокнах возбуждение возникает при нанесении раздражения в перехватах Ранвье (теория Тасаки) и распространяется по мембране волокна сальтаторно (скачкообразно) (рис.1).
Рисунок 1. Проведение возбуждения по миелиновому нервному волокну.
При этом может охватывать не только один, но и два перехвата Ранвье, что обеспечивает надежность, а также увеличивает скорость распространения возбуждения и экономически более выгодна, так как на 1 импульс в безмякотном волокне энергия расходуется в 20 раз больше, чем в мякотном. Таким образом, скорость и расстояние, на которое распространяется возбуждение в безмякотных волокнах пропорциональна диаметру, сопротивлению мембраны и амплитуде ПД; в мякотных прямопропорциональна длине межперехватных участков, а их длина тем больше, чем больше диаметр волокна. Скорость не зависит от силы раздражения.
Теория Германа была экспериментально подтверждена.
Гельмгольц – определил скорость распространения импульса у лягушки; Бабский – определил скорость распространения импульса у человека. Эрландер и Гассер классифицировали различные нервные волокна на три группы А, В и С:
Типы нервных волокон
А – миелинизированные, наибольшего диаметра, скорость 120-70 м в сек, длительность ПД – минимальная, делятся на подгруппы: альфа, бета, гамма, дельта. Пример – аксоны мотонейронов.
В – миелинизированные волокна, меньшего диаметра, скорость 3-18 м в сек, ПД более длителен. Пример – преганглионарные волокна симпатической нервной системы.
С – немиелизированные нервные волокна, скорость менее 2 м в сек, длительность ПД наибольшая. Пример — постганглионарные волокна парасимпатической нервной системы.
Законы проведение возбуждения по нервам.
I закон анатомо-физиологический целостности нервного волокна. Чтобы возбуждение распространялось по нервному волокну необходимо не только его морфологическая целостность, но и физиологическая непрерывность. Препараты для проводниковой анестезии нарушают физиологическую непрерывность тем, что инактивируют натриевую проницаемость в нервных волокнах.
II закон изолированного проведения возбуждения по нервному волокну. В смешанном нерве возбуждение с одного нервного волокна не передается на соседние, так как сопротивление межклеточной жидкости меньше чем сопротивление мембран соседних волокон. Этим обеспечив ается точность проведения информации в нервных волокнах к иннервируемым структурам.
III закон двухстороннее проведение возбуждения. Распространение ПД по мембране нервного волокна возможно в обе стороны, так как строение мембраны на всем протяжении одинаково. В то же время возбуждение не может возвратиться в участок, где оно возникло, так как он находится в состоянии рефрактерности.
Парабиоз. Н.Е. Введенский, исследуя прохождение импульса через отрезок нерва на который воздействую химические или наркотические вещества (альтераторы), наблюдал резкое снижение лабильности. Парабиоз характеризуется постепенным развитием , в котором можно выделить четыре фазы:
I Продромальная (не всегда проявляется, так как очень кратковременная) характеризуется: повышением возбудимости, повышением лабильности.
II Уравнительная – эффекты от сильных и слабых раздражителей уравновешиваются.
III Парадоксальная — на сильные, либо частые раздражения эффект бывает меньше, чем на слабые или редкие.
IV Тормозная – ни сильные, ни слабые раздражения не вызывают сокращения мышц. Через поражённый участок не проходят импульсы.
Если второй парой электродов подействовать на поражённый участок, то возбуждение будет, т.е. ткань ещё жива.
Если снять альтератор, то ткань возвращается к исходному состоянию в обратном порядке фаз IV, III, II, I.
Парабиоз – это стойкое не распространяющееся возбуждение.
Возникают потенциалы меньшие по своей амплитуде, а дальше абортивные потенциалы, не способные распространяться: уменьшаются процессы Na-евой проницаемости, и увеличиваются процессы Na-евой инактивации.
Нервно-мышечная передача.
Взаимодействие человека с внешней средой не возможно представить без его мышечной системы. Производимые движения скелетной мускулатурой необходимы как для выполнения простейших перемещений тела в пространстве, сложных манипуляций хирурга, стоматолога, выражения самых тонких чувств и мыслей с помощью речи, мимики, жестов. Работа сердца обеспечивает кровоснабжение всех органов, работа гладких мышц создает условия для нормального осуществления физиологических процессов, обеспечивающих гомеостаз, практически во всех системах: гастроинтестинальной, сердечно-сосудистой, выделительной, репродуктивной, дыхательной. Ведущая роль скелетной мускулатуры также в производстве тепла и поддержании температуры тела. Мышцы — это «машины», преобразующие химическую энергию в механическую (работу) и тепло. Масса мышц больше чем других органов, 40-50% от массы тела.
В естественных условиях (в нашем организме) возбуждение мышечного волокна (или нескольких мышечных волокон, составляющих мышцу) возникает в результате передачи возбуждения с нервного волокна на мембрану мышечного в местах контакта нерва и мышцы: нервно-мышечных синапсах.
Механизм нервно-мышечной передачи
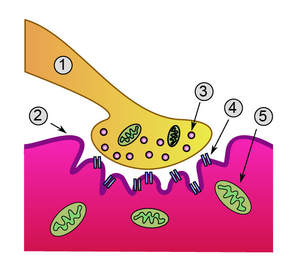
Синапсы представляют собой коммуникационные структуры, которые формируются окончанием нервного волокна и прилегающей к нему мембраной мышечного волокна (пресинаптической нервной и постсинаптической мышечной мембранами) (рис.2).
Рис.2. Мионевральный синапс.
Когда нервный импульс достигает окончания аксона, на деполяризованной пресинаптической мембране открываются потенциалзависимые Са2+ каналы. Вход Са2+ в аксональное расширение (пресинаптическую мембрану) способствует высвобождению химических нейромедиаторов, находящихся в виде везикул (пузырьков) из окончания аксона. Медиаторы (в нервно-мышечном синапсе это всегда ацетилхолин) синтезируются в соме нервной клетки и путем аксонального транспорта транспортируются к окончанию аксона, где и выполняют свою роль. Медиатор диффундирует через синаптическую щель и связывается со специфическими рецепторами на постсинаптической мембране. Так как медиатором в нервно-мышечном синапсе является ацетилхолин, то рецепторы постсинаптической мембраны называют холинорецепторами. В результате этого процесса на постсинаптической мембране открываются хемочувствительные Nа+-каналы, возникает деполяризация, величина которой различна, и зависит от количества выделенного медиатора. Чаще всего возникает локальный процесс, который называют потенциалом концевой пластинки (ПКП). При повышении частоты стимуляции нервного волокна, усиливается деполяризация пресинаптической мембраны, а, следовательно, возрастает количество выделяемого медиатора и число активированных хемочувствительных Nа+каналов на постсинаптической мембране. Таким образом, возникают ПКП, которые по амплитуде деполяризации суммируются до порогового уровня, после чего, на мембране мышечного волокна, окружающей синапс, возникает ПД, который обладает способностью к распространению вдоль мембраны мышечного волокна. Чувствительность постсинаптической мембраны регулируется активностью фермента – ацетилхолинэстеразы (АЦХ-Э), который гидролизует медиатор АЦХ на составные компоненты (ацетил и холин) и возвращает назад – в пресинаптическую бляшку для ресинтеза. Без удаления медиатора на постсинаптической мембране развивается длительная деполяризация, которая ведет к нарушению проведения возбуждения в синапсе – синаптической депрессии. Таким образом, синаптическая связь обеспечивает одностороннее проведение возбуждения с нерва на мышцу, однако на все эти процессы расходуется время (синаптичекая задержка), что приводит к низкой лабильности синапса по сравнению с нервным волокном.
Таким образом, нервно-мышечный синапс является «выгодным» местом, куда можно воздействовать фармакологическими препаратами, изменяя чувствительность рецептора, активность фермента. Эти явления будут часто встречаться в практике врача: например, при отравлении токсином ботулизма – блокируется высвобождение медиатора АЦХ (разглаживание морщин в косметической медицине), блокада холиноререпторов (курареподобными препаратами, бунгаротоксином) нарушает открытие Nа+ каналов на постсинаптической мембране. Фосфоорганические соединения (множество инсектицидов) нарушает эффективность АЦХ-Э и вызывает длительную деполяризацию постсинаптической мембраны. В клинике используют специфические блокаторы нервно-мышечного проведения: блокада холинорецепторов курареподобными препаратами, сукцинилхолином и другими конкурентными ингибиторами, вытесняющими АЦХ с холинорецептора. При заболевании миастении из-за дефицита холинорецепторов на постсинаптической мембране (из-за их аутолитического разрушения) возникает прогрессирующая мышечной слабость, вплоть до полной остановки мышечных сокращений (остановка дыхания). В этом случае используют блокаторы АЦХ-Э, что приводит к увеличению длительности связывания медиатора с меньшим количеством холинорецепторов и несколько увеличивает амплитуду деполяризации постсинаптической мембраны.
Физиология мышц.
Существует 3 типа мышечной ткани: поперечно-полосатая, сердечная, гладкая.
Скелетная мышечная ткань образует большой объем соматической мускулатуры. Содержит хорошо выраженное упорядоченное строение сократительных белков в виде поперечной исчерченности. Связей между отдельными мышечными волокнами нет. Регуляция сокращений происходит сознательно.
Сердечная мышца содержит также поперечную исчерченность, но является функциональным синцитием. Благодаря наличию пейсмекерных клеток, обладает способностью генерировать спонтанные нервные импульсы, обеспечивающие сердечные сокращения.
В гладких мышцах нет поперечной исчерченности, которая бы придавала определенные физические и физиологические свойства этой ткани. Так в отличие от скелетной, которой присуща высокая эластичность, в гладкой мышце больше выражено свойство пластичности, что обусловлено отсутствием четкой упорядоченности миофиламентов актина и миозина. В отличие от регулярной саркомерной структуры скелетных и сердечной мышц, тонкие филаменты гладких мышц присоединены к структурам в цитоплазме, называемым плотными тельцами (прикрепительными бляшками сарколеммы), состоящими из белка десмина. Гладкие мышцы бывают висцеральные (мультиунитарные) и полиэлементные (унитарные).
Висцеральные содержат мостики- щелевые контакты с низким сопротивлением электрическому току – синцитий. Висцеральные мышцы встречаются в стенках полых органов (кишечник, матка, мочеточники, мочевой пузырь).
Полиэлементные гладкие мышцы состоят из отдельных мышечных единиц без соединительных мостиков, поэтому для них характерны точные, четко дозированные сокращения, подобно скелетным. Однако, сокращения этих мышц нельзя контролировать, в отличие от скелетных (мышцы радужки глаза, цилиарного тела, семенных протоков, артерии). Благодаря своему строению (висцеральные) обладают большой пластичностью, однако при определенной предельной степени растяжения способны деполяризоваться и сокращаться (саморегуляция). Пример, давление внутри стенок мочевого пузыря мало изменяется при относительно небольшом его растяжении, если растяжение возрастает резко – происходит сокращение мышц детрузора – эвакуация мочи даже в тех случаях, когда иннервация нарушена. Полиэлементные гладкие мышцы имеют более мощную (плотную) иннервацию и слабое развитие межклеточных контактов (нексусов). Тонус этих мышц и его колебания имеют нейрогенную природу. Имеют парасимпатические и симпатические, а также метасимпатические волокна. Строение нервных окончаний в гладкой мышце отличается от строения нервно-мышечного синапса в скелетной мышцы. В гладкой мышце нет концевых пластинок и отдельных нервных окончаний. По всей длине разветвлений адренергических и холинергических нервных волокон имеются утолщения, называемые варикозами. Они содержат гранулы с медиатором, который выделяется из каждой варикозы. Клетки, лишенные непосредственных контактов с варикозами, активируются ПД, распространяющимися через нексусы на соседние клетки. По ходу следования нервного волокна мышечные клетки могут возбуждаться или тормозиться (стимуляция адренергических волокон уменьшает, а холинергических – увеличивает мышечную активность, в других, например в сосудах, норадреналин – усиливает, а ацетилхолин – уменьшает мышечный тонус. Ионная природа гладкой мышцы определяется особенностями каналов мембраны гладко-мышечной клетки. Основную роль в механизме генерации ПД играют ионы Са2+, но по этим каналам могут внутрь клетки двигаться и другие двухвалетные ионы Ва2+, Mg2+. Вход Са2+ в клетку необходим для поддержания тонуса мышц и развития сокращения, поэтому блокирование Са2+ каналов гладких мышц приводит к ограничению поступления этого иона в цитоплазму миоцитов внутренних органов и сосудов, что широко используется в практической медицине для коррекции моторной функции ЖКТ и тонуса сосудов.
Регуляция мышечных сокращений зависит от объема иннервации. Аксон спинно-мозгового (двигательного) мотонейрона ветвится на несколько терминалей (веточек), каждая из которых подходит к одному мышечному волокну. Поэтому в целостном организме, при возбуждении 1 нервного волокна сокращается группа мышц. Совокупность двигательного нейрона и мышечных волокон, которые он иннервирует называют двигательной единицей. Количество мышечных волокон, входящих в двигательную единицу, различно и зависит о функции, которую реализует каждая конкретная мышца в организме. В мышцах глаз, кисти руки, которые обеспечивают высокоточные, координированные движения, 1 двигательная единица содержит 3-5 мышечных волокон. Двигательные единицы мышц спины, бедра – состоят из нескольких сотен мышечных волокон, которые регулируются одним мотонейроном.
Вернемся к мембране мышечного волокна, на которой распространяется ПД, возникший в результате «успешного» проведения возбуждения через синапс. Продолжением мембраны мышечного волокна является саркотубулярная система, образующая поперечные инвагинации (впячивания) (Т-система поперечных трубочек). Система Т-трубочек выполняет несколько важных функций: является внутриклеточным депо ионов Са2+; сообщается с внеклеточной жидкостью и таким образом регулируется содержание Са2+ в ней; содержит потенциалчувствительные Nа+ каналы, которые дают возможность ПД распространяться как вдоль, так и вглубь мышечного волокна. Система Т-трубочек обеспечивает быстрое и согласованное возбуждение мышечной клетки, так как распространение деполяризации по Т-системе сопряжено с выходом Са2+ из цистерн саркоплазматического ретикулума, обеспечивает инициацию сокращения мышцы. Через Т-трубочки может происходить выделение продуктов обмена (например, молочной кислоты) из мышечной клетки в интерстиций (межклеточное пространство) и далее в кровь. Большой объем клетки скелетной мышцы невозможно было бы активировать быстро, если бы Са2+ поступал из внеклеточной среды. Накоплению Са2+ в саркоплазматическом ретикулуме способствует белок (кальсеквестрин), который непрочно связывает Са2+ в ретикулуме. Высвобождение Са2+ из саркоплазматического ретикулума в скелетных мышцах происходит благодаря взаимодействию Т трубочек и концевых цистерн (триада).
Ионы Са2+ попав в саркоплазму инициируют сокращение, связываясь с белком тропонином – блокатором актина в покое (рис.3).
Рисунок. 3. Механизм мышечного сокращения.
Тонкая нить актина состоит из 2 тяжей фибриллярного актина, на котором нанизаны отдельные глобулы мономера актина (как бусы). Актин содержит активные центры (сайты) связывания с миозином, которые в состоянии покоя заблокированы тропонином. Тропонии подавляет АТФ-азную активность миозина, что делает невозможным расщепление АТФ и мышечные волокна пребывают в расслабленном состоянии. Крупный сократительный белок – миозин, состоящий из 6 полипептидных цепей, уложенных попарно. 2 из них — тяжелые цепи миоглобина, обладающие свойством ферментов. Связанный с трононином Са2+ освобождает активные центры актина для контакта с миозином. В присутствии актина миозиновый фермент (глобулярная головка) разрушает АТФ и взаимодействует с тонкими нитями актина, создавая движущую силу сокращения – образуя поперечные мостики («гребки») и мышца укорачивается (сокращается). Таким образом, АТФ обеспечивает сокращение энергией, гидролизуясь на глобулярных головках миозина. Энергия (Э) которая высвобождается при гидролизе АТФ, превращается в силу сокращения за счет конформационных (пространственных) изменений в миозине (рабочий ход — образование поперечных гребковых мостиков) – это тепло активации, выделяющее при связывании актина и миозина. АДФ, связанная с миозином, уменьшает сродство поперечного мостика к активному центру актина, что инициирует следующую фазу – мышечное расслабление. За счет гидролиза АТФ выделяется Э (тепло укорочения), которая идет на:
1) работу Са-АТФ-азы, (активация насоса происходит за счет неорганического фосфата, образующегося при гидролизе АТФ),
2) за счет Э происходит откачивание против градиента концентрации Са2+ назад в саркоплазматический ретикулум (активный транспорт).
3) АТФ в мышечной клетке обеспечивает работу Na+-К-АТФ-азы, обеспечивающей удаление Na+ из клетки и восстановление потенциала покоя (а, следовательно, и возбудимости) мышечной клетки.
АТФ обеспечивает процессы, как сокращения, так и расслабления. Если Са2+ не будет транспортироваться назад в СПР, то расслабление не наступит, развивается ригидность мышцы (при трупном окоченении), или в живом организме – при посттетанической контрактуре – накопление Са2+ в саркоплазме инициирует длительное мышечное сокращение вне поступления ПД через синапс на мембрану мышечного волокна.
Гладкая мышца содержит также тропомиозин, но не имеет тропонина, соотношение актина к миозину 14-16 к 1, сравните в скелетных соотношение актина к миозину 2 к 1. Гладкая мышца имеет щелевые контакты – это мостики, соединяющие мембраны соседних клеток. Регуляция сократительной активности гладких мышц происходит благодаря связыванию Са2+ с кальмодулином, активирующим киназу легкой цепи миозина, которая приводит к гидролизу АТФ и запускает цикл образования поперечных мостиков.
ПД скелетной мышцы длится около 2-4- мс и проходит по мембране мышечного волокна со скоростью около 5 м/с. 1 ПД вызывает одиночное мышечное сокращение, которое начинается через 2 мс после начала деполяризации мембраны (латентный период) и завершается сокращение почти одновременно с реполяризацией. Длительность одиночного сокращения различна и зависит от типа мышечной ткани. При частых стимулах развивается суммарное мышечное сокращение всех мышечных волокон, обладающих различным сопротивлением мембран к электрическому току. Однако, незначительные отличия порогов возбуждения обеспечивают синхронность мышечного сокращения целой мышцы. Наличие абсолютного рефрактерного периода около 1-3 мс, обуславливает возникновение различных видов тетанусов (суммарных мышечных сокращений). Существует зубчатый и гладкий тетанусы. Частота стимуляции мышцы для развития гладкого тетануса должна быть выше, чем для развития зубчатого. Стимул должен попадать в фазу укорочения мышцы, если же мышцы начала расслабляться, а мы ее стимулирует, то получаем – зубчатый тетанус. Минимальный промежуток времени между последовательными эффективными стимулами во время тетануса не может быть меньше рефрактерного периода, которые приблизительно соответствует длительности ПД. Поскольку мышцы состоят из мышечных волокон с различным уровнем возбудимости, имеется определенная зависимость между величиной стимула и ответной реакцией. Увеличение силы сокращения возможно до определенного предела, после которого амплитуда сокращения остается неизменной при увеличении амплитуды стимула (надо отметить, то в мышце суммируются не ПД, а сокращения). При этом все волокна, входящие в состав мышцы принимают участие в сокращении.
В организме человека имеются быстрые, фазные мышечные волокна (белые), длительность сокращения которых до 7,5 мс, и медленные, тонические (красные), которые обеспечивают сильные и мощные движения, длящиеся до 100 мс. Красные (тонические) имеют много волокон миозина типа I, которые отличаются низкой активностью АТФ-азы миозина. Скорость расщепления АТФ является фактором, предопределяющим частоту гребковых движений, и таким образом, скорость скольжения нитей актина вдоль миозина. Из СПР Са2+ транспортируется медленно, высокая окислительная способность, много капилляров, много миоглобина в структуре миозина (тяжелые цепи), много митохондрий. На стимул реагируют медленно, имеют длительный латентный период сокращения, поэтому способны к длительным, медленным, тоническим сокращениям, более резистентны к утомлению. Главная функция – поддержание положения тела. Белые мышцы содержат волокна миозина II типа. Гликолитический тип окисления, мало миоглобина, митохондрий, это волокна большого диаметра с высокой активность АТФ-азы миозина, способны развить значительную силу, но быстро утомляются.
Сила мышц определяется тем максимальным грузом, который мышца в состоянии чуть-чуть приподнять. Сила различных мышц неодинакова. Для сравнения силы разных мышц максимальный груз, который мышца в состоянии поднять делят на число квадратных сантиметров ее физиологического поперечного сечения. Силовые характеристики выше у мышц с перистым (косым) расположением волокон, при этом физиологическое сечение больше геометрического поперечного сечения. Сумма поперечного сечения не всегда совпадает с физиологическим сечением мышцы (только при параллельном расположении волокон.
Сила сокращения изолированной скелетной мышцы при прочих равных условиях зависит от исходной длины мышцы. Умеренное растяжение мышцы приводит к тому, что развиваемая ею сила возрастает по сравнению с силой, которую развивает нерастянутая мышца. Происходит суммирование пассивного напряжения, обусловленного наличием эластических компонентов мышцы, и активного сокращения (переход к правилу средних нагрузок – физиологический механизм данного закона). Способность совершать работу определяется произведением величины поднятого груза на высоту подъема. Величина работы мышцы постепенно увеличивается с увеличением массы поднимаемого груза, но до определенного предела, после которого увеличение массы груза приводит к снижению величины работы, так как высота подъема груза резко падает. Следовательно, максимальная работа совершается мышцей при средних величинах нагрузок. Сила сокращения и работа не остаются постоянными при статической и динамической работе. В результате продолжительной деятельности работоспособность скелетной мускулатуры понижается. Это явление называют утомлением. При этом снижается сила сокращений, увеличивается латентный период сокращения и период расслабления. Статический режим работы более утомителен, чем динамический (почему объяснить). Накапливаются продукты процессов окисления- молочная пировиноградная кислота, которые снижают возможность генерирования ПД. Нарушаются процессы ресинтеза АТФ и креатинфосфата, необходимых для энергетического обеспечения мышечного сокращения. В естественных условиях мышечное утомление при статической работе в основном определяется неадекватным регионарным кровотоком. Возникает «кислородное голодание» и утомление прогрессивно нарастает.
В 1903 году Сеченов – восстановление работоспособности утомленной мышцы значительно ускоряется при совершении работы другой мышцей в период отдыха утомленной – такой отдых называют активным. Однако высокий уровень умственной деятельности ускоряет процессы развития утомления в мышечной системе (утомление нервных центров).
Нервно-мышечные болезни, генетическое заболевание мышц: симптому, лечение
Нервно-мышечные заболевания характеризуются нарушением функции произвольной мускулатуры, утраты или снижения двигательного контроля, которое может наступать в результате поражения как собственно мышц, так и иметь вторичный характер – вследствие дисфункции нервно-мышечного соединения, поражения периферических нервов или мотонейронов спинного мозга. В клинической картине некоторых нервно-мышечных заболеваний могут присутствовать признаки поражения двигательных ядер ствола головного мозга. Поражения других участков нервной системы, приводящих к нарушению двигательного контроля, в частности пирамидного тракта, согласно общепринятому определению не относятся к нервно-мышечным заболеваниям.
Наиболее частыми симптомами нервно-мышечных заболеваний являются слабость, снижение мышечного объема (атрофия), непроизвольные мышечные подергивания, спазмы, онемение, покалывание и др. Нарушение функции нервно-мышечного соединения может вызывать опущение век (птоз), двоение в глазах (диплопия), и другие признаки мышечной слабости, которые усиливаются в течение дня. При некоторых заболеваниях могут нарушаться глотание, и даже дыхание.
Заболевания мышц: симптомы
- Прогрессирующие мышечные дистрофии – генетическое наследственные заболевание мышц, симптомы которой обычно проявляются в младенческом или детском возрасте, реже – у взрослых. Постепенно нарастает мышечная слабость, особенно заметная в произвольной мускулатуре. В эту группу входят мышечная дистрофия Бекера, врожденная мышечная дистрофия, дистальная мышечная дистрофия, мышечная дистрофия Дюшенна (наиболее часта форма миодистрофии у детей), миодистрофия Эмери-Дрейфуса, плече — лопаточная миодистрофия, миотоническая мышечная дистрофия (наиболее частая форма миодистрофии у взрослых), окулофарингеальная миодистрофия.
- Воспалительные миопатии – называют также миозитами, в основе лежит воспалительный процесс, которые приводит к слабости мышц, в их развитии подчеркивается роль аутоиммунных нарушений, иногда сочетаются с другими аутоиммунными заболеваниями. К ним относятся дерматомиозит, полимиозит, миозит с включениями.
- Митохондриальные миопатии – возникают в результате структурных или биохимических дефектов митохондрий. Синдром Кернса-Сайре, миоклонус эпилепсия с «разорванными красными волокнами», митохондриальная энцефаломиопатия.
- Миотонии — врожденная миотония или болезнь Томсена, дистрофическая миотония, врожденная парамиотония, нейромиотония или болезнь Исаакса
- Другие миопатии – болезнь центрального стержня, миотубудярная миопатия, немалиновая миопатия, периодический гиперкалиемический и гипокалиемический паралич, эндокринные миопатии
Заболевания нервно-мышечного соединения
Вызывают дисфункцию нормальной синаптической передачи импульсов с нервных окончаний на мышечные волокна. В основе заболевания может лежать аутоиммунный процесс.
- миастения гравис
- синдром Ламберта-Итона
- врожденный миастенический синдром
Заболевания периферических нервов
- Мононейропатии — поражение одного нерва, наиболее частой причиной является компрессионное воздействие (туннельные синдромы), травматические повреждения
- Множественные мононейропатии — мультифокальные поражения периферических нервов, связаны обычно с системными или инфекционными заболеваниями, паранеопластическими синдромами
- Полинейропатии — диффузные, симметричные поражения периферических нервов, обычно преобладаюшие в дистальных отделах, почти всегда в клинической картине присутствуют расстройства чувствительности . Могут быть острыми (синдром Гиейна-Барре), хроническими (хроническая воспалительная демиелинизируюшая полинейропатия), приобретенными (токсические, диабетические, паранеопластические) или наследственными (перонеальная мышечная атрофия или болезнь Шарко-Мари-Тус, болезнь Дежерина-Сотта, атаксия Фридрейха).
- Плексопатии — поражения сплетений верхних и нижних конечностей (плечевого и пояснично-крестцового), наиболее частой причиной которых являются травматическое или компрессионное воздействие
- Радикулопатии и полирадикулопатии — поражения двигательных или чувствительных спинальных корешков
Заболевания двигательного нейрона
Прогрессирующее дегенеративное поражение мотонейронов, которое наиболее заметно приводит к нарушению двигательного контроля верхних или нижних конечностей, а также бульбарным расстройствам. Чаще начинаются в среднем возрасте, симптомы могут включать слабость в конечностях, нарушение глотания, речи, походки, слабость лицевой мускулатуры, мышечные спазмы. В эту группу входят, в частности:
- боковой амиотрофический склероз (БАС)
- спинальная мышечная атрофия взрослых
- спинальная мышечная атрофия у младенцев или болезнь Верднига-Гоффмана
- юношеская спинальная мышечная атрофия или болезнь Кугельберга-Веландера
- бульбоспинальная мышечная атрофия или болезнь Кеннеди
Диагноз ставится на основе истории заболевания, тщательного неврологического осмотра, в большинстве случаев используется электромиографическое (ЭМГ) исследование, при сочетании с поражением центрального мотонейрона или для исключения его может применяться транскраниальная магнитная стимуляция, при подозрении на наследственные формы проводится анализ ДНК, аутоимунный характер процесса требует определения специфических антител, может проводиться биопсия участка мышцы, при первично-мышечных поражениях проверяется уровень содержания креатинфосфокиназы (КФК), в последнее время набирает также популярность ультразвуковое исследования мышц и периферических нервов. Диагностический алгоритм, выбор дополнительных исследований зависят от особенностей клинического паттерна и локализации поражения — мышца, нерв, сплетения, корешки, двигательные нейроны.
28. Нервно-мышечный синапс. Механизмы мышечного сокращения (теория скольжения).
В естественных условиях (в нашем организме) возбуждение мышечного волокна (или нескольких мышечных волокон, составляющих мышцу) возникает в результате передачи возбуждения с нервного волокна на мембрану мышечного в местах контакта нерва и мышцы: нервно-мышечных синапсах.
Механизм нервно-мышечной передачи
Синапсы представляют собой коммуникационные структуры, которые формируются окончанием нервного волокна и прилегающей к нему мембраной мышечного волокна (пресинаптической нервной и постсинаптической мышечной мембранами) (рис.2)
Когда нервный импульс достигает окончания аксона, на деполяризованной пресинаптической мембране открываются потенциалзависимые Са2+ каналы. Вход Са2+ в аксональное расширение (пресинаптическую мембрану) способствует высвобождению химических нейромедиаторов, находящихся в виде везикул (пузырьков) из окончания аксона. Медиаторы (в нервно-мышечном синапсе это всегда ацетилхолин) синтезируются в соме нервной клетки и путем аксонального транспорта транспортируются к окончанию аксона, где и выполняют свою роль. Медиатор диффундирует через синаптическую щель и связывается со специфическими рецепторами на постсинаптической мембране. Так как медиатором в нервно-мышечном синапсе является ацетилхолин, то рецепторы постсинаптической мембраны называют холинорецепторами. В результате этого процесса на постсинаптической мембране открываются хемочувствительные Nа+-каналы, возникает деполяризация, величина которой различна, и зависит от количества выделенного медиатора. Чаще всего возникает локальный процесс, который называют потенциалом концевой пластинки (ПКП). При повышении частоты стимуляции нервного волокна, усиливается деполяризация пресинаптической мембраны, а, следовательно, возрастает количество выделяемого медиатора и число активированных хемочувствительных Nа+каналов на постсинаптической мембране. Таким образом, возникают ПКП, которые по амплитуде деполяризации суммируются до порогового уровня, после чего, на мембране мышечного волокна, окружающей синапс, возникает ПД, который обладает способностью к распространению вдоль мембраны мышечного волокна. Чувствительность постсинаптической мембраны регулируется активностью фермента – ацетилхолинэстеразы (АЦХ-Э), который гидролизует медиатор АЦХ на составные компоненты (ацетил и холин) и возвращает назад – в пресинаптическую бляшку для ресинтеза. Без удаления медиатора на постсинаптической мембране развивается длительная деполяризация, которая ведет к нарушению проведения возбуждения в синапсе – синаптической депрессии. Таким образом, синаптическая связь обеспечивает одностороннее проведение возбуждения с нерва на мышцу, однако на все эти процессы расходуется время (синаптичекая задержка), что приводит к низкой лабильности синапса по сравнению с нервным волокном.
Основными этапами передачи возбуждения в нервно-мышечном синапсе являются:
1) возбуждение мотонейрона, распространение потенциала действия на пресинаптическую мембрану;
2) повышение проницаемости пресинаптической мембраны для ионов кальция, ток кальция в клетку, повышение концентрации кальция в пресинаптическом окончаниии;
3) слияние синаптических пузырьков с пресинаптической мембраной в активной зоне, экзоцитоз, поступление медиатора в синаптическую щель;
4) диффузия ацетилхолина к постсинаптической мембране, присоединение его к Н-холинорецепторам, открытие хемозависимых ионных каналов;
5) преобладающий ионный ток натрия через хемозависимые каналы, образование надпорогового потенциала концевой пластинки;
6) возникновение потенциалов действия на мышечной мембране;
7) ферментативное расщепление ацетилхолина, возвращение продуктов расщепления в окончание нейрона, синтез новых порций медиатора.
29. Режимы одиночного и тетанического сокращения мышечного волокна. Формы мышечного сокращения — динамическая и статическая. Концентрический и эксцентрический типы мышечного сокращения.
Одиночное сокращение
Режим сокращений мышечных волокон определяется частотой импульсации мотонейронов. Механический ответ мышечного волокна или отдельной мышцы на однократное их раздражение называется одиночным сокращением.
При одиночном сокращении выделяют:
1. Фазу развития напряжения или укорочения;
2. Фазу расслабления или удлинения.
Фаза расслабления продолжается примерно в два раза дольше, чем фаза напряжения. Длительность этих фаз зависит от морфофункциональных свойств мышечного волокна: у наиболее быстро сокращающихся волокон глазных мышц фаза напряжения составляет 7-10 мс, а у наиболее медленных волокон камбаловидной мышцы — 50-100 мс.
В естественных условиях мышечные волокна двигательной единицы и скелетная мышца в целом работают в режиме одиночного сокращения только в том случае, когда длительность интервала между последовательными импульсами мотонейрона равна или превышает длительность одиночного сокращения иннервируемых им мышечных волокон. Так, режим одиночного сокращения медленных волокон камбаловидной мышцы человека обеспечивается при частоте импульсации мотонейрона менее 10 имп/с, а быстрых волокон глазодвигательных мышц — при частоте импульсации мотонейрона менее 50 имп/с.
В режиме одиночного сокращения мышца способна работать длительное время без развития утомления. Однако в связи с тем, что длительность одиночного сокращения невелика, развиваемое мышечными волокнами напряжение не достигает максимально возможных величин. При относительно высокой частоте импульсации мотонейронов каждый последующий раздражающий импульс приходится на фазу предшествующего напряжения волокона, то есть до того момента, когда оно начинает расслабляться. В этом случае механические эффекты каждого предыдущего сокращения суммируются с последующим. Причем величина механического ответа на каждый последующий импульс меньше, чем на предыдущий. После нескольких первых импульсов последующие ответы мышечных волокон не изменяют достигнутого напряжения, а лишь поддерживают его. Такой режим сокращения называется гладким тетанусом (рис.4.6.). В подобном режиме двигательные единицы мышц человека работают при развитии максимальных изометрических усилий. При гладком тетанусе развиваемое ДЕ напряжение в 2-4 раза больше, чем при одиночных сокращениях.
В тех случаях, когда промежутки между последовательными импульсами мотонейрона меньше времени полного цикла одиночного сокращения, но больше длительности фазы напряжения, сила сокращения ДЕ колеблется. Этот режим сокращения называется зубчатым тетанусом (рис. 4.6.).
Гладкий тетанус для быстрых и медленных мыши достигается при разных частотах импульсации мотонейронов. Зависит это от времени одиночного сокращения. Так, гладкий тетанус для быстрой глазодвигательной мышцы проявляется при частотах свыше 150-200 имп/с, а у медленной камбаловидной мышцы — при частоте около 30 имп/с. В режиме тетанического сокращения мышца способна работать лишь короткое время. Это объясняется тем, что из-за отсутствия периода расслабления она не может восстановить свой энергетический потенциал и работает как бы «в долг».
14. Нервно-мышечные соединения.
Соединение Нервно-Мышечное (Neuromuscular Junction), Синапс Нервно-Мышечный (Myoneural Junction)
зона контакта двигательного окончания и мышечного волокна, которое иннервируется им. Каждое мышечное волокно иннервируется веточкой аксона двигательного нейрона, который, оканчиваясь на волокне, образует двигательную концевую пластинку. Структура, соединяющая нервное окончание и мышечное волокно — аксо-мышечный синапс — состоит из пресинаптической мембраны (плазматическая мембрана нервного окончания) и постсинаптической мембраны (плазматическая мембрана мышечного волокна), разделенных синаптической щелью, куда из нервного окончания выделяется нейромедиатор, вызывая сокращение мышцы.
Нервно-мышечный синапс (мионевральный синапс) — эффекторное нервное окончание на скелетном мышечном волокне.Нервный отросток проходя через сарколемму мышечного волокна утрачивает миелиновую оболочку и образует сложный аппарат с плазматической мембраной мышечного волокна, образующийся из выпячиваний аксона и цитолеммы мышечного волокна, создавая глубокие «карманы». Синаптическая мембрана аксона и постсинаптическая мембрана мышечного волокна разделены синаптической щелью. В этой области мышечное волокно не имеет поперечной исчерченности, характерно скопление митохондрий и ядер. Терминали аксонов содержат большое количество митохондрий и синаптических пузырьков с медиатором (ацетилхолином). Электронная микрофотография среза нервномышечного синапса. Т — окончание аксона, М — мышечное волокно. Стрелка указывает на складки базальной мембраны. Шкала 0.3 мкм[1]Двигательные нервные окончания в гладкой мышечной ткани построены проще — безмиелиновые пучки аксонов проникают между глиоцитами к пласту гладких мышц и образуют булавовидные расширения, которые содержат холинергические и адренергические пузырьки.
15. Нейромедиаторы, их строение и функции, образование и метаболизм. Классификация нейромедиаторов.
Нейромедиа́торы (нейротрансмиттеры, посредники) — биологически активные химические вещества, посредством которых осуществляется передача электрического импульса с нервной клетки через синаптическое пространство между нейронами. Нервный импульс, поступающий в пресинаптическое окончание, вызывает освобождение в синаптическую щель медиатора. Молекулы медиаторов реагируют со специфическими рецепторными белками клеточной мембраны, инициируя цепь биохимических реакций, вызывающих изменение трансмембранного тока ионов, что приводит к деполяризации мембраны и возникновению потенциала действия. Нейромедиаторы являются, как и гормоны, первичными мессенджерами, но их высвобождение и механизм действия в химических синапсах сильно отличается от такового гормонов. В пресинаптической клетке везикулы, содержащие нейромедиатор, высвобождают его локально в очень маленький объём синаптической щели. Высвобожденный нейромедиатор затем диффундирует через щель и связывается с рецепторами на постсинаптической мембране. Диффузия является медленным процессом, но пересечение такой короткой дистанции, которая разделяет пре- и постсинаптические мембраны (0,1 мкм или меньше), происходит достаточно быстро и позволяет осуществлять быструю передачу сигнала между нейронами или между нейроном и мышцей.Недостаток какого-либо из нейромедиаторов может вызывать разнообразные нарушения, например, различные виды депрессии. Также считается, что формирование зависимости от наркотиков и табака связано с тем, что при употреблении этих веществ задействуются механизмы производства нейромедиатора серотонина, а также других нейромедиаторов, блокирующие (вытесняющие) аналогичные естественные механизмы.
Аминокислоты (и их производные). К ним относят таурин, норадреналин, ДОФАминГАМК, глицин, ацетилхолин, гомоцистеин и некоторые другие (адреналин, серотонин, гистамин, серотонин).
Таурин. Таурин образуется из аминокислоты цистеина. Сначала происходит окисление серы в SH-группе до остатка серной кислоты (процесс идет в несколько стадий), а затем происходит декарбоксилирование. Таурин — это необычная кислота, в которой нет карбоксильной группы, а имеется остаток серной кислоты.
Таурин принимает участие в проведении нервного импульса в процессе зрительного восприятия.
Ацетилхолин. Для синтеза холина требуются аминокислоты серин, метионин. Этаноламин может быть использован и в готовом виде. Но, как правило, из крови в нервную ткань поступает уже готовый холин. Второй же предшественник этого нейромедиатора — Ацетил-КоА, синтезируется в нервных окончаниях.
Продукт этой реакции ацетилхолин участвует в синаптической передаче нервного импульса. Он накапливается в синаптических пузырьках, образуя комплексы с отрицательно заряженным белком везикулином. Передача возбуждения с одной клетки на другую осуществляется с помощью специального синаптического механизма.
Синапс – это функциональный контакт специализированных участков плазматических мембран двух возбудимых клеток. Синапс состоит из пресинаптической мембраны, синаптической щели и постинаптической мембраны. Мембраны клеток в месте контакта имеют утолщения в виде бляшек – нервных окончаний. Нервный импульс, достигший нервного окончания, не в состоянии преодолеть возникшее перед ним препятствие — синаптическую щель. После этого электрический сигнал преобразуется в химический. Пресинаптическая мембрана содержит специальные канальные белки, подобные белкам, формирующим натриевый канал в мембране аксона. Они тоже реагируют на мембранный потенциал, изменяя свою конформацию и формируют канал. В результате ионы Са2+ проходят через пресинаптическую мембрану по градиенту концентраций в нервное окончание. Градиент концентраций Са2+ создается работой Са2+-зависимой.
АТФазы – кальциевым насосом. Повышение концентрации Са2+ внутри нервного окончания вызывает слияние 200-300 имеющихся там везикул, заполненных ацетилхолином, с плазматической мембраной. Далее ацетилхолин секретируется в синаптическую щель путем экзоцитоза, и присоединяется к рецепторным белкам, расположенным на поверхности постсинаптической мембраны.
Ацетилхолиновый рецептор представляет собой трансмембранный олигомерный гликопротеиновый комплекс, состоящий из 6 субъединиц: 2-бета, 1-гамма и 1-дельта. Плотность расположения белков-рецепторов в постсинаптической мембране очень велика — около 20000 молекул на 1 мкм2. Пространственная структура рецептора строго сооответствует конформации медиатора.
При взаимодействии с ацетилхолином белок-рецептор так изменяет свою конформацию, что внутри него формируется натриевый канал. Катионная селективность канала обеспечивается тем, что ворота канала сформированы отрицательно заряженными аминокислотами. Таким образом, повышается проницаемость постсинаптической мембраны для натрия и возникает новый импульс (или сокращение мышечного волокна). Деполяризация постсинаптической мембраны вызывает диссоциацию комплекса «ацетилхолин-белок-рецептор» и ацетилхолин освобождается в синаптическую щель. Как только ацетилхолин оказывается в синаптической щели, он за 40 мкс подвергается быстрому гидролизу под действием фермента ацетилхолинэстеразы.
Во время гидролиза ацетилхолина образуется промежуточный фермент-субстратный комплекс, в котором ацетилхолин связан с активным центром фермента через серин.
Необратимое ингибирование холинэстеразы вызывает смерть. Ингибиторами холинэстеразы являются фосфорорганические соединения (хлорофос, дихлофос, табун, зарин, зоман, бинарные яды). Эти вещества связываются ковалентно с серином в активном центре фермента. Некоторые из них синтезированы в качестве инсектицидов, а некоторые – в качестве боевых отравляющих веществ (нервно-паралитические яды). Смерть наступает в результате остановки дыхания.
Обратимые ингибиторы холинэстеразы используются как лечебные препараты. Например, при лечении глаукомы и атонии кишечника.
Катехоламины: норадреналин и дофамин. Адренэргические синапсы встречаются в постганглионарных волокнах, в волокнах симпатической нервной системы, в различных отделах головного мозга. Катехоламины в нервной ткани синтезируются по общему механизму из тирозина. Ключевой фермент синтеза – тирозингидроксилаза, ингибируемая конечными продуктами.
Норадреналин – медиатор в постганглионарных волокнах симпатической и в различных отделах ЦНС.
Дофамин – медиатор проводящих путей, тела нейронов которого расположены в отделе мозга, который отвечает за контроль произвольных движений. Поэтому при нарушении дофаминэргической передачи возникает заболевание паркинсонизм.
Катехоламины, как и ацетилхолин, накапливаются в синаптических пузырьках и тоже выделяется в синаптическую щель при поступлении нервного импульса. Но регуляция в адренэргическом рецепторе происходит иначе. В пресинаптической мембране здесь имеется специальный регуляторный белок — ахромогранин (Мм = 77 кДа), который в ответ на повышение концентрации медиатора в синаптической щели связывает уже выделившийся медиатор и прекращает его дальнейший экзоцитоз. Фермента, разрушающего медиатор, в адренэргических синапсах нет. После передачи импульса молекулы медиатора перекачивается специальной транспортной системой путем активного транспорта с участием АТФ обратно через пресинаптическую мембрану и включается вновь в везикулы. В пресинаптическом нервном окончании излишек медиатора может быть инактивирован моноаминоксидазой, а также катехоламин-О-метилтрансферазой путем метилирования по оксигруппе. Кокаин тормозит активный транспорт катехоламинов.
Передача сигнала в адренэргических синапсах протекает по механизму, известному Вам из лекций по теме «Биохимия гормонов» с участием аденилатциклазной системы. Связывание медиатора с постсинаптическим рецептором почти мгновенно вызывает повышение концентрации ц-АМФ, что приводит к быстрому фосфорилированию белков постсинаптической мембраны. В результате изменяется генерация нервных импульсов постсинаптической мембраной (тормозится). В некторых случаях непосредственной причиной этого является повышение проницаемости постсинаптической мембраны для калия, либо снижением проводимости для натрия (эти события приводят к гиперполяризации).
ГАМК – тормозной медиатор. Повышает проницаемость постсинаптических мембран для ионов калия. Это ведет к изменению мембранного потенциала.
Глицин – тормозной медиатор, по вызываемым эффектам подобен гамк.
Пептиды. Имеют в своем составе от трех до нескольких десятков аминокислотных остатков. Функционируют только в высших отделах нервной системы.
Эти пептиды, как и катехоламины, выполняют функцию не только нейромедиаторов, но и гормонов. Передают информацию от клетки к клетке по системе циркуляции.
Сюда относятся:
1. нейрогипофизарные гормоны (вазопрессин, либерины, статины). Эти вещества одновременно и гормоны и медиаторы;
2. гастроинтестинальные пептиды (гастрин, холецистокинин). Гастрин вызывает чувство голода, холецистокинин вызывает чувство насыщения, а также стимулирует сокращение желчного пузыря и функцию поджелудочной железы;
3. опиатоподобные пептиды (или пептиды обезболивания). Образуются путем реакций ограниченного протеолиза белка-предшественника проопиокортина. Взаимодействуют с теми же рецепторами, что и опиаты (например, морфин), тем самым имитируют их действие. Общее название — эндорфины — вызывают обезболивание. Они легко разрушаются протеиназами, поэтому их фармакологический эффект незначителен;
4. пептиды сна. Их молекулярная природа не установлена. Известно лишь, что их введение животным вызывает сон;
5. пептиды памяти (скотофобин). Накапливается в мозге крыс при тренировке на избегание темноты;
6. пептиды — компоненты ренин-ангиотензиновой системы. Показано, что введение ангиотензина-II в центр жажды головного мозга вызывает появление этого ощущения и стимулирует секрецию антидиуретического гормона.
16. Нейроглия. Источники онтогенетического развития нейроглии. Нейроглия (от нейро… и греч. gl?a — клей), глия, клетки в мозге, своими телами и отростками заполняющие пространства между нервными клетками — нейронами — и мозговыми капиллярами. Каждый нейрон окружен несколькими клетками Н., которая равномерно распределена по всему мозгу и составляет около 40% его объёма. Клетки Н. — число их в центральной нервной системе (ЦНС) млекопитающих около 140 млрд. — мельче нейронов в 3—4 раза и отличаются от них по морфологическим и биохимическим признакам. С возрастом количество нейронов в ЦНС уменьшается, а клеток Н. — увеличивается, т.к. последние, в отличие от нейронов, сохраняют способность к делению. Основные функции Н.: создание между кровью и нейронами гемато-энцефалического барьера, необходимого как для защиты нейронов, так и главным образом для регуляции поступления веществ в ЦНС и их выведения в кровь; обеспечение реактивных свойств нервной ткани (образование рубцов после травмы, участие в реакциях воспаления, в образовании опухолей и др.). Различают астроглию, олигоглию, или олигодендроглию, и эпендиму, которые вместе составляют макроглию, а также микроглию, занимающую особое положение среди клеток Н.
17. Макроглия. Особенности структуры и функции разных видов макроглии (астроциты и олигодендроциты). Макроглия — клетки в мозге, заполняющие пространства между нервными клетками — нейронами — и окружающими их капиллярами. М. — основная ткань нейроглии, часто с ней отождествляемая; в отличие от микроглии, имеет общее с нейронами происхождение из нервной трубки. Более крупные клетки М., образующие астроглию и эпендиму, участвуют в деятельности гемато-энцефалического барьера, в реакции нервной ткани на повреждения и инфекции. Более мелкие, так называемые сателлитные клетки нейронов (олигодендроглия), участвуют в образовании миелиновых оболочек отростков нервных клеток — аксонов, обеспечивают нейроны питательными веществами, особенно в период усиленной активности мозга. Олигодендроциты — Белое вещество головного и спинного мозга, периферические нервы. Окружает нервные клетки и их аксоны; образует вокруг нервных волокон миелиновую оболочку, играющую роль биологического изолятора, который препятствует распространению возбуждения на соседние нейроны. Не исключено участие в поляризации и метаболизме нервных клеток. Олигодендроциты имеют то же происхождение, что и астроциты. По размерам они меньше, чем астроциты и имеют меньше отростков. Основная масса олигодендроцитов располагается в белом веществе мозга и ответственна за образование миелина. Эти олигодендроциты обладают длинными отростками. Олигодендроциты, расположенные в периферической нервной системе, называются Шванновскими клетками. Те олигодендроциты, которые находятся в сером веществе, располагаются, как правило, вокруг тел нейронов, плотно прилегая к ним. Поэтому их называют клетками-сателлитами. Они характеризуются наличием коротких отростков Астроциты – серое и белое в-во головного и спинного мозга. Обеспечение транспорта веществ из кровеносных капилляров к нервным клеткам; участие в образовании гематоэнцефалического барьера. Происходит из спонгиобластов, развивающихся в клетки, имеющие множество отростков. Длинные извитые отростки астроцитов переплетаются с отростками нейронов. Значительное число отростков астроцитов представляют собой «ножки», плотно прилегающие к капиллярам и покрывающие собой почти всю поверхность сосуда. Астроциты, расположенные в местах концентрации тел нейронов (серое вещество), образуют больше отростков, чем астроциты в белом веществе. Таким образом, астроциты — это клетки, располагающиеся между капиллярами и телами нейронов и осуществляющие транспорт веществ из крови в нейроны и обратно. Кроме того, астроглия связывает с кровеносным руслом спинномозговую жидкость.
18.Строение и функции эпендимы. Эпендима – выстилает все внутренние полости в головном и спинном мозге. Выполняет роль барьера между веществом мозга и омывающей его спинномозговой жидкостью; регулирует секрецию и состав спинномозговой жидкости. Эпендима — клетки в мозге животных и человека, выполняющие в центральной нервной системе разграничительную, опорную и секреторную функции; форма нейроглии. Э. дифференцируется из клеток нервной трубки в раннем эмбриогенезе. Клетки Э. (эпендимоциты) выстилают стенки спинномозгового канала и желудочков головного мозга. Их тела вытянуты, на свободном конце — реснички (теряемые во многих отделах мозга после рождения особи), биение которых способствует циркуляции спинномозговой жидкости. От противоположного конца эпендимоцита в мозг отходит длинный, ветвящийся отросток. Э. стенок 3-го желудочка мозга (ее клетки называются таницитами), возможно, осуществляет обмен биологически активными веществами между нейронами прилегающих областей мозга, спинномозговой жидкостью и сосудами воротной системы гипофиза.
19. Строение, функции и происхождение микроглии. Микроглиоциты, или микроглия, представляют собой мелкие клетки, рассеянные в центральной нервной системе. При травмах или дегенерации нервной ткани они способны мигрировать к очагу повреждения, где превращаются в крупные макрофаги, поглощающие путем фагоцитоза продукты распада. Таким образом, микроглиоциты препятствуют развитию воспалительных процессов и распространению инфекции в нервной ткани. Микроглия – белое в-во головного и спинного мозга преимущественно около кровеносных сосудов. Выполняет защитную роль, сходную с ролью макрофагов; предотвращает попаданию в нервную систему чужеродных субстанций. Клетки микроглии происходят из мезодермы. Как видно из названия, они отличаются небольшими размерами. Эти клетки могут активно передвигаться и выполнять фагоцитарные функции. Благодаря способности к активной миграции микроглия распределена по всей центральной нервной системе.
Нервно-мышечный аппарат — Департамент физической культуры и спорта
В. Н. Селуянов, В. А. Рыбаков, М. П. Шестаков
Глава 1. Модели систем организма
1.1.2. Нервно-мышечный аппарат
Человек выполняет физические упражнения и тратит энергию с помощью нервно мышечного аппарата.
Нервно-мышечный аппарат — это совокупность двигательных единиц. Каждая ДЕ включает мотонейрон, аксон и совокупность мышечных волокон. Количество ДЕ остается неизменным у человека (Физиология человека, 1998). Количество МВ в мышце возможно и поддается изменению в ходе тренировки, однако, не более чем на 5 % (Хоппелер, 1987). Поэтому этот фактор роста функциональных возможностей мышцы не имеет практического значения. Внутри МВ происходит гиперплазия (рост количества элементов) многих органелл: миофибрилл, митохондрий, саркоплазматического ретикулума (СПР), глобул гликогена, миоглобина, рибосом, ДНК и др. Изменяется также количество капилляров, обслуживающих МВ (Физиология мышечной деятельности, 1982).
Миофибрилла является специализированной органеллой мышечного волокна (клетки). Она у всех животных имеет примерно равное поперечное сечение. Состоит из последовательно соединенных саркомеров, каждый из которых включает нити актина и миозина. Между нитями актина и миозина могут образовываться мостики и при затрате энергии, заключенной в АТФ, может происходить поворот мостиков, т. е. сокращение миофибриллы, сокращение мышечного волокна, сокращение мышцы. Мостики образуются в присутствии в саркоплазме ионов кальция и молекул АТФ, в расслабленном мышечном волокне концентрация ионов кальция очень низкая. Увеличение количества миофибрилл в мышечном волокне приводит к увеличению его силы, скорости сокращения и размера. Вместе с ростом миофибрилл происходит разрастание и других обслуживающих миофибриллы органелл, например, саркоплазматического ретикулума.
Саркоплазматический ретикулум — это сеть внутренних мембран, которая образует пузырьки, канальцы, цистерны. В МВ СПР образует цистерны, в этих цистернах скапли-ваются ионы кальция (Са). Предполагается, что к мембранам СПР прикреплены ферменты гликолиза, поэтому при прекращении доступа кислорода происходит значительное разбухание каналов. Это явление связано с накоплением ионов водорода (Н), которые вызывают частичное разрушение (денатурацию) белковых структур, присоединение воды к радикалам белковых молекул (Меерсон Ф. З., 1965, 1975, 1981, 1988; Панин Л. Е., 1983; Hoppeler H., 1985, 1986). Для механизма мышечного сокращения принципиальное значение имеет скорость откачивания Са из саркоплазмы, поскольку это обеспечивает процесс расслабления мышцы. В мембраны СПР встроены натрий калиевые и кальциевые насосы, поэтому можно предположить, что увеличение поверхности мембран СПР по отношению к массе миофибрилл должно вести к росту скорости расслабления МВ. Следовательно, увеличение максимального темпа или скорости расслабления мышцы (интервала времени от конца электрической активации мышцы до падения механического напряжения в ней до нуля) должно говорить об относительном приросте мембран СПР.
Поддержание максимального темпа обеспечивается запасами в МВ АТФ, КрФ, массой миофибриллярных митохондрий, массой саркоплазматических митохондрий, массой гликолитических ферментов и буферной емкостью содержимого мышечного волокна и крови. Все эти факторы влияют на процесс энергообеспечения мышечного сокращения, однако, способность поддерживать максимальный темп должна зависеть преимущественно от митохондрий СПР. Увеличивая количество окислительных МВ или, другими словами, аэробных возможностей мышцы, продолжительность упражнения с максимальной мощностью растет. Обусловлено это тем, что поддержание концентрации КрФ в ходе гликолиза ведет к закислению МВ, торможению процессов расхода АТФ из за конкурирования ионов Н с ионами Са на активных центрах головок миозина (Hermansen, 1981). Поэтому процесс поддержания концентрации КрФ при преобладании в мышце аэробных процессов идет по мере выполнения упражнения все более эффективнее. Важно также то, что митохондрии активно поглощают ионы водорода (Hermansen, 1981; Holloshzy, 1971. 1975; Hoppeler, 1986), поэтому при выполнении кратковременных предельных упражнений (10-30 с) их роль больше сводится к буферированию закисления клетки.
Митохондрии располагаются везде, где требуется в большом количестве энергия АТФ. В мышечных волокнах энергия требуется для сокращения миофибрилл, поэтому вокруг них образуются миофибриллярные митохондрии (Лениджер, 1966; Лузиков, 1980).
