Бактерии — Википедия
Бакте́рии (лат. Bacteria), от др.-греч. βακτήριον — «палочка») — домен прокариотических микроорганизмов. Бактерии обычно достигают нескольких микрометров в длину, их клетки могут иметь разнообразную форму: от шарообразной до палочковидной и спиралевидной. Бактерии — одна из первых форм жизни на Земле и встречаются почти во всех земных местообитаниях. Они населяют почву, пресные и морские водоёмы, кислые горячие источники, радиоактивные отходы[2] и глубинные слои земной коры. Бактерии часто являются симбионтами и паразитами растений и животных. Большинство бактерий к настоящему времени не описано, и представители лишь половины типов бактерий могут быть выращены в лаборатории[3]. Бактерии изучает наука бактериология — раздел микробиологии.
Один грамм почвы в среднем содержит 40 миллионов бактериальных клеток, а в миллилитре свежей воды можно найти миллион клеток бактерий. На Земле насчитывается около 5⋅1030 бактерий[4]
Человеческую микрофлору составляют 39 триллионов бактериальных клеток (само тело человека состоит из около 30 триллионов клеток)[10]. Наиболее многочисленна кишечная микрофлора, кожа также заселена многими бактериями[11]. Большинство бактерий, обитающих в человеческом теле, безвредны за счёт сдерживающего действия иммунной системы или приносят пользу (микрофлора человека). Ряд бактерий патогенны для человека. Такие инфекционные болезни, как холера, сифилис, сибирская язва, проказа и бубонная чума, вызываются бактериями. Наибольшее число смертей вызвано бактериальными респираторными инфекциями[en], и один лишь туберкулёз ежегодно убивает 2 миллиона человек (преимущественно в Африке южнее Сахары)
Первоначально бактерии поместили в царство растений в составе класса Schizomycetes. Сейчас известно, что бактерии, в отличие от растений и других эукариот, не имеют оформленного ядра и, как правило, мембранных органелл. Традиционно бактериями называли всех прокариот, однако в 1970-х годах было показано, что прокариоты представлены двумя независимыми доменами — бактериями и археями (эукариоты составляют третий домен)
Слово «бактерия» происходит от лат. bacterium, производного от греч. βακτηρία, что означает «трость, палочка», так как первые описанные бактерии были палочковидными[16][17].
Предки современных бактерий были одноклеточными микроорганизмами, которые стали одной из первых форм жизни на Земле, появившись около 4 миллиардов лет назад. Почти три миллиарда лет вся жизнь на Земле была микроскопической
Бактерии сыграли важнейшую роль в появлении эукариот. Считается, что эукариотическая клетка возникла, когда бактерии стали эндосимбионтами одноклеточных организмов, вероятно, близких к современным археям
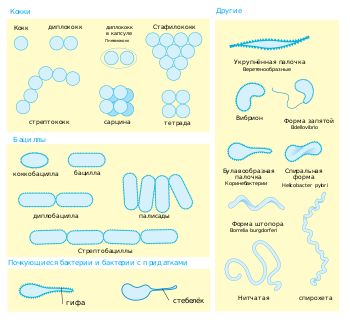 Различные морфотипы бактерий
Различные морфотипы бактерийБактериальные клетки имеют чрезвычайно разнообразную морфологию (то есть форму и размер). Как правило, бактериальные клетки в десять раз мельче эукариотических и достигают 0,5—5 мкм в длину. Однако есть и бактерии, видимые невооружённым глазом: так,
Большинство бактерий имеют шарообразную (кокки) или палочковидную (бациллы) форму

Многие виды бактерий существуют в виде одиночных клеток, однако у некоторых видов клетки образуют характерные скопления: например, клетки Neisseria объединены в пары, у Streptococcus — в цепочки, у Staphylococcus — в скопления в виде грозди винограда. Некоторые бактерии могут формировать более сложные многоклеточные структуры. Так, Actinobacteria формируют длинные филаменты (внутриклеточные нитевидные образования), Myxococcales образуют плодовые тела, а Streptomyces образуют ветвящиеся нити[34]. Иногда такие сложные структуры появляются только при некоторых условиях. Например, при нехватке аминокислот клетки Myxococcales определяют расположение соседних клеток того же вида с помощью чувства кворума, движутся навстречу друг другу и формируют плодовые тела до 500 мкм длиной, состоящие из около 100 тысяч бактериальных клеток
Бактерии часто прикрепляются к какой-либо поверхности и формируют плотные скопления, известные как биоплёнки, или более крупные скопления — бактериальные маты. Толщина биоплёнок и матов может составлять от нескольких микрометров до полуметра, в их состав могут входить бактерии разных видов, а также археи и протисты. В биоплёнках наблюдается сложное расположение клеток и внеклеточных компонентов, которые формируют вторичные структуры, известные как микроколонии, через которые проходит сеть каналов, обеспечивающая лучшую диффузию питательных веществ
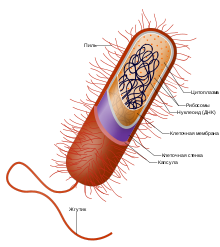 Строение клетки типичной грамположительной бактерии (обратите внимание на наличие только одной клеточной мембраны)
Строение клетки типичной грамположительной бактерии (обратите внимание на наличие только одной клеточной мембраны)Внутриклеточные структуры[править | править код]
Бактериальная клетка окружена мембраной, состоящей в основном из фосфолипидов. Мембрана окружает всё содержимое клетки и выступает в роли барьера для удержания в клетке питательных веществ, белков и других компонентов цитоплазмы[41]. В отличие от клеток эукариот, у бактерий, как правило, отсутствуют крупные мембранные органеллы, такие как ядро, митохондрии, хлоропласты
Многие важные биохимические реакции, такие как образование АТФ, происходят за счёт градиента концентрации определённых ионов по разные стороны мембраны, что создаёт разность потенциалов, как в батарейке. Поскольку у бактерий нет мембранных органелл, такие реакции (например, перенос электронов) протекают при участии мембраны бактериальной клетки, обращённой во внешнюю среду в случае грамположительных бактерий или в периплазматическое пространство в случае грамотрицательных бактерий[49]. Однако у многих фотосинтезирующих бактерий мембрана образует многочисленные складки, которые заполняют почти всё внутреннее пространство клетки[50]. На этих складках располагаются светопоглощающие комплексы, однако у некоторых бактерий, например, зелёных серных бактерий, светопоглощающие комплексы находятся внутри особых мембранных пузырьков — хлоросом[51].
У большинства бактерий нет ядра, окружённого мембранами, и их генетический материал, в большинстве случаев представленный единственной кольцевой молекулой ДНК[en], находится в цитоплазме в составе нуклеоида, имеющего неправильную форму[52]. Нуклеоид содержит не только геномную ДНК, но также взаимодействующие с ней белки и РНК. Как все живые организмы, бактерии имеют рибосомы, которые обеспечивают синтез белков, однако размеры и структура рибосом бактерий отличаются от таковой у рибосом архей и эукариот[53].
У некоторых бактерий в цитоплазме имеются гранулы, запасающие питательные вещества, такие как гликоген[54], полифосфат[55], сера[56] или полигидроксиалканоаты[57]. Ряд бактерий, например, фотосинтезирующие цианобактерии, имеют газовые вакуоли, с помощью которых они регулируют свою плавучесть, благодаря чему могут перемещаться между слоями воды с разным содержанием питательных веществ и уровнем освещённости[58].
Внеклеточные структуры[править | править код]
Поверх мембраны бактериальной клетки располагается клеточная стенка. Клеточная стенка бактерий состоит из пептидогликана, также известного как муреин, который состоит из полисахаридных цепочек, связанных пептидными линкерами из D-аминокислот[59]. По химическому составу бактериальная клеточная стенка отличается от клеточной стенки растений и грибов, у которых она состоит из целлюлозы и хитина соответственно[60]. Клеточная стенка архей также не содержит пептидогликана. Клеточная стенка жизненно необходима для многих видов бактерий, и некоторые антибиотики, такие как пенициллин, подавляют биосинтез пептидогликана и тем самым убивают бактерию[60].
В широком смысле по составу клеточной стенки бактерий принято делить на грамположительные и грамотрицательные. Название этих типов связано с их дифференциальной окраской по методу Грама, который долгое время используется для классификации бактерий[61]. У грамположительных бактерий имеется толстая клеточная стенка, состоящая из многих слоёв пептидогликана и тейхоевых кислот. У грамотрицательных бактерий, напротив, клеточная стенка значительно тоньше и включает всего лишь несколько слоёв пептидогликана, а поверх неё залегает вторая мембрана, содержащая липополисахариды и липопротеины. Большинство бактерий грамотрицательны, и только фирмикуты и актинобактерии грамположительны (ранее они были известны как грамположительные бактерии с низким GC-составом и грамположительные бактерии с высоким GC-составом соответственно)[62]. Различия между грамположительными и грамотрицательными бактериями могут обусловливать различную чувствительность к антибиотикам. Например, ванкомицин эффективен только против грамположительных бактерий и не действует на грамотрицательные бактерии[63]. У некоторых бактерий строение клеточной стенки не соответствует в строгом смысле ни грамположительному, ни грамотрицательному типу. Например, у микобактерий имеется толстый слой пептидогликана, как у грамположительных бактерий, который покрыт внешней мембраной, как у грамотрицательных бактерий[64].
У многих бактерий клетка покрыта так называемым S-слоем, состоящим из плотно уложенных молекул белков[65]. S-слой обеспечивает химическую и физическую защиту клетки и может выступать в роли макромолекулярного диффузионного барьера. Функции S-слоя разнообразны, но плохо изучены, однако известно, что у Campylobacter он выступает фактором вирулентности, а у Geobacillus stearothermophilus[en] он содержит поверхностные ферменты[66].
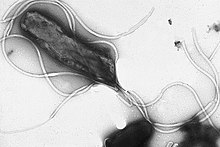 Электронная микрофотография Helicobacter pylori, на клеточной поверхности располагается множество жгутиков
Электронная микрофотография Helicobacter pylori, на клеточной поверхности располагается множество жгутиковУ многих бактерий имеются жгутики, представляющие собой плотные белковые структуры около 20 нм в диаметре и до 20 мкм в длину. Они обеспечивают подвижность клеток и по строению и механизму работы не имеют ничего общего с эукариотическими жгутиками. Движение жгутиков бактерий происходит за счёт энергии, которая высвобождается при движении ионов по электрохимическому градиенту через клеточную мембрану[67].
Нередко клетки бактерий покрыты фимбриями, которые представляют собой белковые филаменты, достигающие 2—10 нм в диаметре и до нескольких мкм в длину. Они покрывают всю поверхность бактериальной клетки и в электронный микроскоп выглядят как волоски. Предполагается, что фимбрии участвуют в прикреплении клеток бактерий к различным поверхностям и друг к другу, а у многих патогенных бактерий они являются факторами вирулентности[68]. Пили — это клеточные белковые придатки, более толстые, чем фимбрии, которые обеспечивают перенос генетического материала от одной бактериальной клетки к другой в ходе конъюгации (половые пили)[69]. Кроме того, пили IV типа участвуют в движении[70].
Многие бактериальные клетки выделяют покрывающий их гликокаликс различной сложности строения: от тонкого неструктурированного слоя внеклеточных полимеров[en] до высоко структурированной капсулы. Гликокаликс может защищать бактерию от поглощения эукариотическими клетками, например, макрофагами, входящими в состав иммунной системы[71]. Он также может выступать в роли антигена, который используется для распознавания бактериальных клеток иммунной системой, а также участвовать в формировании биоплёнок и прикреплении бактериальных клеток к поверхностям[72].
Образование внеклеточных структур бактериальной клетки обеспечивается бактериальными системами секреции. Они транспортируют белки из цитоплазмы в периплазматическое пространство или во внешнюю среду. Известно несколько типов бактериальных систем секреции, кроме того, бактериальные системы секреции нередко выступают в роли факторов вирулентности[73].
Эндоспоры[править | править код]
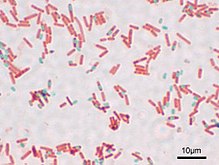 Окрашенный препарат Bacillus subtilis. Вегетативные клетки красные, споры зелёные.
Окрашенный препарат Bacillus subtilis. Вегетативные клетки красные, споры зелёные.Представители нескольких родов грамположительных бактерий, таких как Bacillus, Clostridium, Sporohalobacter[en], Anaerobacter[en] и Heliobacterium, образуют покоящиеся структуры, обладающие повышенной устойчивостью к неблагоприятным факторам внешней среды и называемые эндоспорами[74]. Эндоспоры образуются в цитоплазме клетки, и, как правило, в одной клетке может сформироваться только одна эндоспора. Каждая эндоспора содержит ДНК и рибосомы, окружённые поверхностным слоем цитоплазмы, поверх которого залегает плотная многослойная оболочка, состоящая из пептидогликана и разнообразных белков[75].
Внутри эндоспор не протекают метаболические процессы, и они могут выживать при сильнейших неблагоприятных физических и химических воздействиях, таких как интенсивное УФ-излучение, γ-излучение, детергенты, дезинфицирующие агенты, замораживание, давление и высыхание[en][76]. Эндоспоры могут сохранять жизнеспособность в течение миллионов лет[77][78], и с их помощью бактерии могут оставаться живыми даже в условиях вакуума и космического излучения[79]. Некоторые бактерии, формирующие эндоспоры, патогенны. Так, сибирская язва развивается после вдыхания спор грамположительной бактерии Bacillus anthracis, а попадание эндоспор Clostridium tetani в глубокие открытые раны может привести к столбняку[80].
У бактерий наблюдается колоссальное разнообразие видов метаболизма[81]. Традиционно таксономия бактерий строилась на основе их метаболических особенностей, однако она во многом не совпадает с современной классификацией, построенной на геномных последовательностях[82]. Бактерии делятся на три типа питания в зависимости от ключевых черт метаболизма: источника энергии, донора электронов и источника углерода[83].
Бактерии получают энергию двумя способами: поглощая свет в ходе фотосинтеза или окисляя химические соединения (хемосинтез)[84]. Хемотрофы используют в качестве источника энергии химические вещества, перенося электроны с имеющегося донора на конечный акцептор электронов в ходе окислительно-восстановительной реакции. Высвобождающаяся при этой реакции энергия далее используется для нужд метаболизма. В зависимости от того, какое вещество используется как донор электронов, хемотрофы подразделяются ещё на несколько групп. Бактерии, использующие неорганические вещества, такие как водород, угарный газ или аммиак, называются литотрофами, а бактерии, окисляющие органические соединения, называются органотрофами. Бактерий также классифицируют в зависимости от веществ, выступающих акцепторами электронов. У аэробов акцептором электронов выступает кислород, а анаэробы используют для этого другие соединения, такие как нитрат, сульфат и углекислый газ[84].
Многие бактерии удовлетворяют свои потребности в углероде за счёт органических соединений; такие бактерии называются гетеротрофами. Другие бактерии, например, цианобактерии и некоторые пурпурные бактерии, являются автотрофами, то есть получают углерод, фиксируя углекислый газ[85]. В некоторых условиях метанотрофные бактерии используют метан и как источник электронов, и как источник углерода[86].
| Тип питания | Источник энергии | Источник углерода | Примеры |
|---|---|---|---|
| Фототрофы | Солнечный свет | Органические вещества (фотогетеротрофы) или фиксированный углекислый газ (фотоавтотрофы) | Цианобактерии, зелёные серные бактерии, Chloroflexi[en], пурпурные бактерии |
| Литотрофы | Неорганические соединения | Органические вещества (литогетеротрофы) или фиксированный углекислый газ (литоавтотрофы) | Thermodesulfobacteria[en], Hydrogenophilaceae[en], Nitrospirae[en] |
| Органотрофы | Органические соединения | Органические вещества (хемогетеротрофы) или фиксированный углекислый газ (хемоавтотрофы) | Bacillus, Clostridium, Enterobacteriaceae |
Метаболизм бактерий имеет огромное значение для экологической стабильности и деятельности человека. Например, некоторые бактерии являются единственными фиксаторами атмосферного азота (с помощью фермента нитрогеназы)[87]. Другими важными для окружающей среды химическими процессами, осуществляемыми бактериями, являются денитрификация, восстановление сульфата и ацетогенез[88][89]. Метаболические процессы бактерий также могут служить источниками загрязнения. Так, сульфатредуцирующие бактерии образуют высокотоксичные соединения ртути (метил- и диметилртуть)[90]. Ряд анаэробных бактерий осуществляет брожение для получения энергии, и его побочные продукты (например, этанол при спиртовом брожении) попадают в окружающую среду. Факультативные анаэробы могут переключаться между получением энергии с помощью брожения и получением её с помощью дыхания с различными акцепторами электронов в зависимости от условий окружающей среды[91].
 Многие бактерии размножаются бинарным делением (сравните с митозом и мейозом на этой схеме)
Многие бактерии размножаются бинарным делением (сравните с митозом и мейозом на этой схеме)В отличие от многоклеточных организмов, у одноклеточных организмов (и бактерий в том числе) рост, то есть увеличение клетки в размерах, и размножение путём деления клеток тесно связаны[92]. Бактериальные клетки достигают определённого размера и после этого делятся бинарным делением. В оптимальных условиях бактерии растут и делятся очень быстро, описан пример морской псевдомонады, популяция которой может удваиваться каждые 9,8 минуты[93]. При бинарном делении образуются две дочерние клетки, идентичные материнской. Некоторые бактерии, хотя и размножаются простым делением, образуют более сложные структуры, предназначенные для распространения дочерних клеток. Примером могут служить плодовые тела миксобактерий и воздушные гифы стрептомицетов. Некоторые бактерии способны к почкованию, когда дочерняя клетка образует вырост на материнской, который впоследствии отделяется и переходит к самостоятельной жизни[94].

В лаборатории бактерии растят на твёрдых или жидких средах. Твёрдые среды, такие как агар, используются для изоляции[en] чистых культур бактериальных штаммов. Жидкие среды используются, когда необходимо измерять скорость роста или получить большое количество клеток. При выращивании бактерий в жидкой среде с перемешиванием получаются однородные клеточные культуры, однако сложно заметить загрязнение другими бактериями. Для идентификации отдельных бактерий используются селективные среды, содержащие антибиотики, специфические питательные вещества или, наоборот, лишённые каких-то соединений[96].
Для большинства лабораторных методов выращивания бактерий необходимы большие количества питательных веществ, чтобы обеспечить быстрое получение больших объёмов клеток. Однако в естественных условиях питательные вещества ограничены, и бактерии не могут размножаться бесконечно. Из-за ограниченного количества питательных веществ в ходе эволюции появились различные стратегии роста. Некоторые виды растут чрезвычайно быстро, когда питательные вещества доступны, например, цианобактерии нередко вызывают цветение водоёмов, насыщенных органикой[97]. Другие организмы адаптированы к жёстким условиям окружающей среды, например, бактерии рода Streptomyces выделяют антибиотики, которые подавляют рост конкурирующих бактерий[98]. В природе многие виды бактерий живут сообществами (например, в виде биоплёнок), которые обеспечивают каждую клетку необходимым питанием и защищают от неблагоприятных условий[39]. Некоторые организмы и группы организмов растут только в составе сообществ и не могут быть выделены в чистую культуру[99].
Динамику роста бактериальной популяции можно подразделить на четыре фазы. Когда популяция бактерий попадает в среду, богатую питательными веществами, клетки начинают адаптироваться к новым условиям. Первая фаза роста называется лаг-фазой, это период медленного роста, когда клетки адаптируются к среде, богатой питательными веществами, и готовятся к быстрому росту. Во время лаг-фазы происходит интенсивный синтез белков[100]. За лаг-фазой следует логарифмическая, или экспоненциальная фаза, во время которой происходит быстрый экспоненциальный рост. Скорость, с которой клетки растут во время этой фазы, называют скоростью роста, а время, которое необходимо для удвоения клеточной популяции, называется временем генерации. В ходе лог-фазы питательные вещества потребляются с максимальной скоростью, до тех пор пока одно из необходимых соединений не кончится и не начнёт подавлять рост. Третья фаза роста называется стационарной, она начинается при нехватке питательных веществ для быстрого роста. Скорость метаболизма падает, и клетки начинают расщеплять белки, не являющиеся строго необходимыми. Во время стационарной фазы экспрессируются гены, белковые продукты которых участвуют в репарации ДНК, метаболизме антиоксидантов и транспорте питательных веществ[101]. Финальная фаза роста — фаза смерти, при которой запас питательных веществ исчерпывается и бактерии погибают[102].
У большинства бактерий геном представлен единственной кольцевой молекулой ДНК (её иногда называют хромосомой), а размер генома варьирует от 160 тысяч пар оснований (п. о.) у эндосимбиотической бактерии Carsonella ruddii[en][103] до примерно 13 миллионов п. о. у почвенной бактерии Sorangium cellulosum[en][104]. Впрочем, у ряда представителей родов Streptomyces и Borrelia геном представлен единственной линейной хромосомой[105][106], а у некоторых видов рода Vibrio имеется более одной хромосомы[107]. Многие бактерии также содержат плазмиды — маленькие внехромо
Стрептококки — Википедия
Материал из Википедии — свободной энциклопедии
Стрептококки[1] (лат. Streptococcus; от греч. στρεπτός — «цепочка» и греч. κόκκος — «зерно») — род шаровидных или овоидных аспорогенных (не образуют споры) грамположительных хемоорганотрофных факультативно-анаэробных бактерий из семейства Streptococcaceae. Паразиты животных и человека. Обитают в дыхательных и пищеварительных путях, особенно в полости рта, носа, в толстом кишечнике.
Отношение суммы гуанина и цитозина к общему весу оснований в молекуле ДНК равен 33—42%. Типичные клетки менее 1 мкм в диаметре, располагаются попарно или цепочками, неподвижны, кроме штаммов группы D. Образуют капсулу, легко превращаются в L-форму. Питательные потребности сложные. Обычно растут на средах с добавлением крови, сыворотки крови, асцитической жидкости, углеводов. Температурный оптимум — 37°, pH 7,2—7,4. На плотных средах формируют мелкие плоские сероватые колонии, на жидких средах дают крошковатый пристеночный и придонный рост, на кровяном агаре — зоны альфа- или бетагемолиза. Встречаются и негемолитические штаммы. Ферментируют углеводы с образованием кислоты, расщепляют аминокислоты (аргинин, серин). Представители групп В и D продуцируют пигменты красного и жёлтого цвета. На питательных средах и в организме хозяина синтезируют внеклеточные стрептодорназу, стрептолизины, стрептокиназу, лейкоцидин, бактериоцины. Генетический обмен происходит трансформацией и трансдукцией, но не конъюгацией. Стрептококки погибают при пастеризации и действии рабочих растворов многих дезинфектантов, антисептиков, они чувствительны к пенициллину, тетрациклинам, аминогликозидам и др. препаратам. Устойчивость вырабатывается медленно. Однако для лечения инвазивной стрептококковой инфекции применение пенициллина неэффективно и даже может повлечь серьезные осложнения[2].
Принята классификация рода на основании специфического полисахарида С и поверхностных антигенов белковой природы (по Р. Лендсфилд). По С-полисахариду выделяют серогруппы A, В, С, D … О. Экстракты С-полисахарида получают автоклавированием культуры при 1,1 атм 15 мин., обработкой её горячей соляной кислотой, азотной кислотой, формамидом, пепсином, трипсином. Серологическая специфичность связана с аминосахарами. У S. группы А, дающих матовые или слизистые колонии, на поверхности находится М-белок, который детерминирует типовую специфичность. В группе А по этому признаку выделяют 55 варов, определяемых с помощью реакции агглютинации или реакции преципитации с типоспецифическими сыворотками. М-белок обладает антифагоцитарной активностью, выраженными протективными свойствами. Вспомогательную роль в дифференциации играют также поверхностные Т- и R-антигены. Т-антиген термолабилен, устойчив к пепсину, трипсину и кислотам.
Классификация стрептококков основана на типе гемолиза эритроцитов, наблюдаемом при росте на кровяном агаре: альфа-гемолитические стрептококки — вызывают неполный гемолиз с зеленоватым оттенком гемолитической зоны (так называемые зеленящие стрептококки), бета-гемолитические стрептококки — вызывают полный гемолиз и негемолитические стрептококки («гамма-гемолиз»).
В свою очередь, бета-гемолитические стрептококки делятся на группы A, B и т. д. до U в соответствии со строением карбогидрата C клеточной стенки (классификация Lancefield).
Медицински значимые стрептококки:
- 1) Streptococcus pyogenes (прежнее название Streptococcus haemolyticus) — бета-гемолитические стрептококки группы А. Диаметр клеток — 0,6—1 мкм, многие штаммы образуют капсулу. Капсульные штаммы растут в виде слизистых колоний, при стоянии переходящих в матовые; бескапсульные штаммы формируют блестящие глянцевидные колонии. Не растут при 10 и 45°, в бульоне с 6,5% хлорида натрия, при рН 9,6; в молоке с 0,1% метиленового синего. Ферментируют глюкозу, лактозу, сахарозу, салицин, трегалозу, не ферментируют инулин, сорбит, глицерин, гиппурат натрия. Большинство штаммов продуцируют стрептолизины, стрептокиназу, стрептодорназу, некоторые — эритрогенный токсин. Обитают у человека в глотке в норме и могут вызывать различные заболевания;
- 2) Streptococcus pneumoniae — объединяют в группу пневмококковых инфекций. Возбудитель представляет собой кокки с вытянутым полюсом, располагаются попарно или короткими цепочками, неподвижны, спор не формируют, при обитании в организме образуют капсулу, хемоорганотрофы, факультативные анаэробы. Паразит дыхательных путей человека. Встречается в норме при различных заболеваниях. Вызывает острые пневмонии и бронхит у детей и взрослых;
- 3—4) Streptococcus faecalis, Streptococcus faecies — стрептококк группы D, которые обычно объединяются в группу энтерококков, вызывают септические процессы;
- 5—8) Streptococcus sanguis, Streptococcus salivarius, Streptococcus mitis, Streptococcus mutans — гемолитические и негемолитические стрептококки различных серогрупп, продуцирующие полисахариды и принимающие участие в образовании зубных бляшек, предполагается их этиологическая роль при кариесе;
- 9) Streptococcus lactis (переведен в род Lactococcus) — молочнокислый стрептококк, молочнокислая бактерия.
Нетаксономическая группа комменсантных малопатогенных стрептококковых бактерий Streptococcus viridans, включает в значительной степени непатогенную микрофлору человека, некоторые представители которой при гемолизе дают зелёную окраску, откуда и произошло название группы „viridans“ от лат. Viridis — «зелёный».
Заболевания, вызываемые стрептококками[править | править код]
- Красильников А.П. Микробиологический словарь-справочник. — Мн: «Беларусь», 1986. — С. 288-289.
Молочнокислые бактерии — Википедия
Материал из Википедии — свободной энциклопедии
Молочнокислые бактерии — группа микроаэрофильных грамположительных микроорганизмов, сбраживающих углеводы с образованием молочной кислоты как одного из основных продуктов[1]. Молочнокислое брожение стало известно людям на заре развития цивилизации. С тех пор им пользуются в домашних условиях и в пищевой промышленности для переработки и сохранения еды и напитков. Традиционно к молочнокислым бактериям относят неподвижных, неспорообразующих кокковидных или палочковидных представителей отряда Lactobacillales (например, Lactococcus lactis или Lactobacillus acidophilus). В эту группу входят бактерии, которые используются в ферментации молочных продуктов, овощей. Молочнокислые бактерии играют важную роль в приготовлении теста, какао и силоса. Несмотря на близкое родство, патогенные представители отряда Lactobacillales (например, пневмококки Streptococcus pneumoniae) обычно исключаются из группы молочнокислых бактерий.
С другой стороны, дальние родственники Lactobacillales из класса актинобактерий — бифидобактерии часто рассматриваются в одной группе с молочнокислыми бактериями. Некоторых представителей аэробных спорообразующих родов Bacillus (например, Bacillus coagulans) и Sporolactobacillus (например, Sporolactobacillus inulinus) иногда включают в группу молочнокислых бактерий из-за сходства в метаболизме углеводов и их роли в пищевой промышленности[2].
В природе молочнокислые бактерии встречаются на поверхности растений (например, на листьях, фруктах, овощах, зёрнах), в молоке, наружных и внутренних эпителиальных покровах человека, животных, птиц, рыб. Таким образом, помимо своей роли в производстве пищи и кормов, молочнокислые бактерии играют важную роль в живой природе, сельском хозяйстве и нормальной жизнедеятельности человека.
- Одним из наиболее распространенных видов молочнокислых бактерий является Lactococcus lactis. Это неподвижные кокки, не образующие спор, хорошо окрашиваются анилиновыми красителями и по Граму, в молодом виде имеют форму стрептококка. На мясо-пептонном агаре дают точечные круглые колонии, в толще агара — чечевицеобразные. L. lactis разлагает сахар без образования газов на две молекулы молочной кислоты. Наиболее благоприятная для развития температура составляет +30…+35 °C.
- Молочнокислый лактококк постоянно встречается в самопроизвольно скисшем молоке. Под воздействием этой бактерии молоко обычно свертывается в течение первых 24 часов. Когда содержание молочной кислоты достигнет 6—7 г на литр, сбраживание сахара прекращается, так как более высокая кислотность губительно воздействует на молочнокислый лактококк.
- Lactobacillus delbrueckii subsp. bulgaricus — болгарская палочка. Бактерия названа так, потому что в своё время была выделена из болгарского кислого молока «йогурта». Неспорооробразующая неподвижная бактерия, достигающая 20 мкм в длину и часто соединяющаяся в короткие цепочки.
- Является термофильной, и лучше всего растет при температуре от 42 °C. Молоко свертывает быстро, причем содержание молочной кислоты в нём доходит до 32 г/л, что в пять раз больше, чем при заражении молочнокислым стрептококком.
- ↑ Salminen, S.; von Wright, A; and Ouwehand, AC (eds.). Lactic Acid Bacteria: Microbiological and Functional Aspects (англ.). — 3rd ed.. — New York: Marcel Dekker (англ.)русск., 2004.
- ↑ Holzapfel, WH; Wood, BJB (eds.). The genera of lactic acid bacteria (неопр.). — 1st ed.. — London Blackie Academic & Professional, 1998.
Пептострептококки — Википедия
Материал из Википедии — свободной энциклопедии
| Пептострептококки | |||
|---|---|---|---|
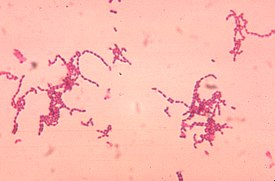 Характерный рост представителей рода пептострептококков | |||
| |||
Peptostreptococcus Kluyver and van Niel 1936 emend. Ezaki et al. 2001 | |||
Пептострептококки[1] (лат. Peptostreptococcus) — род анаэробных грамположительных неспорообразующих бактерий из семейства Peptostreptococcaceae. Небольшие клетки сферической формы, обнаруживающиеся в виде коротких цепочек. Обычно перемещаются, используя реснички[2].
Пептострептококки — медленно растущие бактерии с повышенной устойчивостью к антимикробным препаратам[3].
Пептострептококки проявляют чувствительность к бета-лактамным антибиотикам[4].
Пептострептококки относятся к нормальной микрофлоре человека, обитая в ротовой полости, на коже, в кишечнике (в основном, в толстой кишке) и влагалище[5][6], дыхательных путях здоровых людей, составляя от 13 до 18 % всех встречающихся у человека грамположительных анаэробных кокков.
Относится к условно-патогенной микрофлоре, и проявляется при иммунодепрессии или травматизации прилегающих тканей септическими осложнениями.
Они изолированы с высокой частотой от всех образцов. Анаэробные грамположительные кокки, такие как Peptostreptococcus, являются вторыми наиболее часто восстанавливаемыми анаэробами и составляют примерно одну четверть найденных анаэробных изолятов. Чаще всего анаэробные грамположительные кокки обычно восстанавливаются вместе с другими анаэробными или аэробными бактериями из различных инфекций в разных местах человеческого тела. Это вносит вклад в трудность выделения пептострептококковых организмов[7].
Пептострептококк представляет единственный род среди анаэробных грамположительных кокков, которые встречаются при клинических инфекциях. Таким образом, виды пептострептококка рассматриваются как клинически значимые анаэробные кокки. Другие аналогичные клинически значимые анаэробные кокки включают виды Veillonella (грамотрицательные кокки) и микроаэрофильные стрептококки (аэротолерантные). Анаэробные грамположительные кокки включают различные клинически значимые виды рода Peptostreptococcus [8].
Анаэробные грамположительные кокки являются частью нормальных желудочно-кишечных комменсалов. Они изолированы примерно в 20 % случаев внутрибрюшных инфекций, таких как перитонит. Обнаружены при абсцессах печени, селезёнки и брюшной полости. Как в верхних дыхательных путях и зубных инфекциях, анаэробные грамположительные кокки восстанавливаются в смеси с другими бактериями. В этом случае они смешиваются с организмами кишечного происхождения, такими как E. coli, группа бактериоидов fragilis и клостридий[7][8].
[источник не указан 871 день] Включаемые ранее в род пептострептококки виды P. asaccharolyticus, P. magnus, P. micros, P. prevotii, P. vaginalis согласно современным представлениям переименованы и перенесены в другие роды: Peptoniphilius asaccharolyticus, Finegoldia magnus, Micromonas micros, Anaerococcus prevotii, Anaerococcus vaginalis соответственно.
- ↑ Атлас по медицинской микробиологии, вирусологии и иммунологии : Учебное пособие для студентов медицинских вузов / Под ред. А. А. Воробьёва, А. С. Быкова. — М. : Медицинское информационное агентство, 2003. — С. 40. — 236 с. — ISBN 5-89481-136-8.
- ↑ Sherris Medical Microbiology (неопр.) / Ryan KJ; Ray C. G.. — 4th. — McGraw-Hill Education, 2004. — ISBN 0-8385-8529-9.
- ↑ Higaki S., Kitagawa T., Kagoura M., Morohashi M., Yamagishi T. Characterization of Peptostreptococcus species in skin infections (англ.) // J Int Med Res : journal. — 2000. — Vol. 28, no. 3. — P. 143—147. — DOI:10.1177/147323000002800305. — PMID 10983864.
- ↑ Brook I. 2007. Treatment of anaerobic infection. Expert Rev Anti Infect Ther. 5: 991—1006.
- ↑ Hoffman, Barbara. Williams gynecology (неопр.). — 2nd. — New York: McGraw-Hill Medical, 2012. — С. 65. — ISBN 0071716726.
- ↑ Senok Abiola C., Verstraelen Hans, Temmerman Marleen, Botta Giuseppe A., Senok Abiola C. Probiotics for the treatment of bacterial vaginosis (англ.) // Cochrane Database of Systematic Reviews : journal. — 2009. — No. 4. — P. CD006289. — DOI:10.1002/14651858.CD006289.pub2. — PMID 19821358.
- ↑ 1 2 Finegold S. M. Anaerobic Bacteria in Human Disease. Orlando, Fla: Academic Press; 1977.
- ↑ 1 2 Brook I. Anaerobic Infections. In: Diagnosis and Management. 4th Edition. New York: Informa Healthcare USA Inc.; 2007.
Бацилла (форма) — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 декабря 2019; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 декабря 2019; проверки требует 1 правка.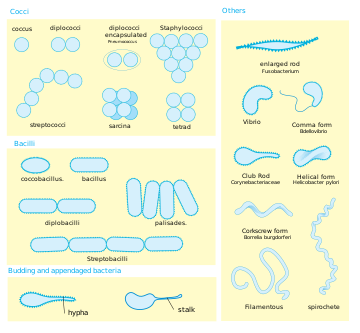 Для бактерий характерно большое разнообразие форм клеток
Для бактерий характерно большое разнообразие форм клетокБаци́лла, или па́лочка (лат. bacilli, ед. ч. bacillum или bacillus — «палочка»), — палочковидная бактерия, способная образовывать споры, в отличие от неспороносных — собственно бактерий. Морфологически также выделяют так называемые коккобациллы, клетки которых более округлые, но длина клетки всё ещё превышает ширину, как, например, у Bacteroides fragilis, чумной палочки (Yersinia pestis), Bordetella bronchiseptica, гемофильной палочки (Haemophilus influenzae).
Бациллы могут образовать парные соединения — диплобациллы и цепочки — стрептобациллы. Примером стрептобациллы, дающей характерные и очень длинные, в виде извитых нитей, цепочки, является сибироязвенная палочка.
Образование спор служит одним из лучших признаков для классификации микробов. В зависимости от положения споры в клетке изменяется форма бациллы. К примеру, у столбнячной палочки (Clostridium tetani) споры обычно находятся на концах клеток, придавая последним форму барабанных палочек. Такие формы бактерий называются плектридиями.
У других форм, например у маслянокислых бактерий, споры образуются в средней части клеток, отчего последние получают веретенообразную форму. Такие формы называются клостридиями.
Палочковидная форма встречается у многих бактерий, в том числе у представителей семейств Энтеробактерии (Enterobacteriaceae), Bacillaceae [en], Lactobacillaceae [en], Brucellaceae [en], Pseudomonadaceae.
Пили — Википедия
Материал из Википедии — свободной энциклопедии
 Клетки E. coli с многочисленными пилями
Клетки E. coli с многочисленными пилямиПили́, или фи́мбрии, или ворси́нки[1] — нитевидные белковые структуры, расположенные на поверхности клеток многих бактерий. Размер пилей варьирует от долей мкм до более чем 20 мкм в длину и 2—11 нм в диаметре. Пили участвуют в передаче генетического материала между бактериальными клетками (конъюгация), прикреплении бактерий к субстрату и другим клеткам, отвечают за адаптацию организмов, служат местами прикрепления многих бактериофагов.
Пили состоят из одного или нескольких типов спирально уложенных белковых молекул, которые называют пилинами[en] или фимбринами. Часто на концах пилей присутствуют особые прикрепительные субъединицы (адгезины), но иногда весь пиль обладает адгезивными свойствами. Структурно пили могут быть от тонких нитевидных образований до толстых палочкообразных структур с осевыми отверстиями. Очень тонкие пили (диаметром менее 2 нм) называют «кудряшками», они сливаются в пушистую липкую массу на поверхности клеток, которая обеспечивает их агрегацию. Пили-кудряшки являются амилоидными[en] фибриллами, родственными белкам, формирующим амилоидные бляшки в мозге пациентов с болезнью Альцгеймера[2]. Часто пили разбросаны по всей поверхности клетки, но иногда локализуются только на одном её конце[3].
Основная функция большинства пилей заключается в обеспечении правильного позиционирования особых молекул, обеспечивающих адгезию клеток. Взаимодействие бактерий с другими про- и эукариотическими клетками, обеспечиваемое пилями, является важным этапом заселения эпителия и проникновения патогенных бактерий в клетки организма хозяина, образования биоплёнок и переноса генетического материала при конъюгации. Некоторые пили задействованы в движении бактериальных клеток. Пили иногда служат рецепторами бактериофагов. Например, при инфекции мочевыводящих путей[en], вызванной патогенными штаммами Escherichia coli, клетки прикрепляются к эпителию мочевого пузыря с помощью пилей, на конце которых находятся молекулы белка-адгезина FimH, который взаимодействует с остатками маннозы на поверхности эпителиальных клеток. Благодаря прикреплению к эпителию клетки бактерии не выводятся из организма с мочой. Пили являются важными факторами вирулентности[en] многих кишечных бактерий, таких как Salmonella enterica, энтеропатогенные штаммы E. coli[en], Vibrio cholerae. Прикрепление пилей к эукариотическим клеткам может запускать в них определённые сигнальные каскады. Например, прикрепление пилей Neisseria к эпителиальным клеткам вызывает в последних выход ионов кальция в цитоплазму, при этом кальций является важным вторичным посредником в передаче сигнала в эукариотических клетках[4][5].
В образовании пилей, помимо самих белков-пилинов, участвуют дополнительные белки, способствующие правильной сборке. У грамотрицательных бактерий они должны пройти через клеточную мембрану, периплазматическое пространство и наружную мембрану. Ключевую роль в сборке пилей играет периплазматический шаперон PapD и транспортный белок внешней мембраны, известный как Usher-белок. PapD связывается с пилинами, вышедшими в периплазму, и доставляет их к Usher-белку, после чего высвобождается назад в периплазму. Доставленные к Usher-белку пилины приобретают активированную конформацию и далее собираются в пили[6].
Пили-кудряшки[en] образуются по специфическому, тщательно регулируемому механизму. У E. coli в их сборке задействованы белковые продукты оперонов csgBA и csgDEFG. Фибрилла кудряшки образована белком CsgA, который, наряду с минорным белком CsgB, участвует в фазе нуклеации фибриллы. Когда нуклеация пройдена и начинается рост ворсинки, CsgB включается в неё. Фибриллы CsgA очень устойчивы и разрушаются лишь под действием 75 %-ной муравьиной кислоты. Оперон csgDEFG кодирует транскрипционный фактор CsgD и три предполагаемых фактора сборки пилей[2].
Традиционно пили подразделяют на 4 типа.
Некоторые учёные подразделяют пили на пили главного типа и альтернативного типа. Пили главного типа включают пили типов I—III по традиционной классификации. Они располагаются по всей поверхности клетки и прикрепляются непосредственно к её наружной поверхности. Пили главного типа выполняют только адгезионные функции. Пили альтернативного типа (тип IV по традиционной классификации) образуются в количестве 1—2 на клетку и располагаются на одном или двух её полюсах. Они, подобно жгутикам, имеют базальное тело и заякорены в клеточной мембране, а потому насквозь проходят периплазму и наружную мембрану. Пили альтернативного типа участвуют не только в адгезии. Они могут быстро разбираться от основания, при этом дистальные их концы остаются прикреплёнными к субстрату или другой клетке. За счёт этого одна клетка может подтягиваться ближе к другой, что особенно важно при конъюгации[8].
- ↑ Нетрусов, Котова, 2012, с. 54.
- ↑ 1 2 Кассимерис, Лингаппа, Плоппер, 2016, с. 940.
- ↑ Нетрусов, Котова, 2012, с. 54—56.
- ↑ Нетрусов, Котова, 2012, с. 56—58.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 939.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 939—940.
- ↑ Пиневич, 2006, с. 338.
- ↑ Пиневич, 2006, с. 338—340.
- Пиневич А. В. Микробиология. Биология прокариотов: в 3 т. — СПб.: Издательство С.-Петербургского университета, 2006. — Т. I. — 352 с. — ISBN 5-288-04057-5.
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп. — М.: Издательский центр «Академия», 2012. — 384 с. — ISBN 978-5-7695-7979-0.
- Современная микробиология / Под ред. Й. Ленгелера, Г. Древса, Г. Шлегеля. — М.: Мир, 2005. — Т. 1. — 654 с.
Кишечная палочка — Википедия
| Кишечная палочка | |||
|---|---|---|---|
 | |||
| |||
Escherichia coli (Migula 1895) | |||
Кишечная палочка (лат. Escherichia coli) — вид грамотрицательных палочковидных бактерий, широко распространённых в нижней части кишечника теплокровных животных. Большинство штаммов E. coli являются безвредными, однако серотип O157:H7 может вызывать тяжёлые пищевые отравления у людей[1] и животных[2]. Безвредные штаммы являются частью нормальной флоры кишечника человека и животных. Кишечная палочка приносит пользу организму хозяина, например, синтезируя витамин K[3], а также предотвращая развитие патогенных микроорганизмов в кишечнике[4][5].
E. coli не всегда обитают только в желудочно-кишечном тракте, способность некоторое время выживать в окружающей среде делает их важным индикатором для исследования образцов на наличие фекальных загрязнений[6][7]. Бактерии легко могут быть выращены в лабораторных условиях, поэтому кишечная палочка играет важную роль в генетических исследованиях. E. coli является одним из самых изученных прокариотических микроорганизмов и одним из самых важных объектов биотехнологии и микробиологии.
E. coli была описана немецким педиатром и бактериологом Теодором Эшерихом в 1885 году[6]. В настоящее время кишечную палочку относят к роду эшерихий (Escherichia), названному в честь Теодора Эшериха семейства энтеробактерий[8].
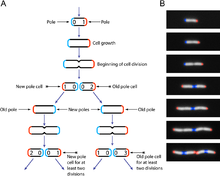 Модель последовательного бинарного деления E. coli
Модель последовательного бинарного деления E. coliШтамм — это совокупность особей внутри вида, которая обладает свойствами, отличными от свойств других особей. Часто такие отличия могут быть обнаружены только на молекулярном уровне, однако имеют эффект на физиологию бактерии или жизненный цикл. Разные штаммы E. coli часто специфичны к определённым хозяевам, что делает возможным определение источника фекального заражения в образцах[6][7]. Например, если известно, какие штаммы E. coli представлены в образце воды, можно определить источник заражения, например, человек, другое млекопитающее или птица.
Новые штаммы E. coli появляются в результате мутаций и горизонтального переноса генов[9]. Некоторые штаммы вырабатывают особенности, губительные для организмов хозяина, такие вирулентные штаммы могут вызывать диарею, что неприятно в случае взрослых и может привести к летальному исходу у детей в развивающихся странах[10]. Более вирулентные штаммы, например, O157:H7 вызывают тяжёлые заболевания и даже приводят к смерти у пожилых людей, маленьких детей и лиц с ослабленным иммунитетом[10][11].
E. coli — грамотрицательная бактерия, факультативный анаэроб, не образует эндоспор. Клетки палочковидные, со слегка закруглёнными концами, размером 0,4—0,8 × 1—3 мкм, объём клетки составляет около 0,6—0,7 мкм³[12][13]. Кишечная палочка может жить на разных субстратах. В анаэробных условиях E. coli образует в качестве продукта жизнедеятельности лактат, сукцинат, этанол, ацетат и углекислый газ. Часто при этом образуется молекулярный водород, который мешает образованию указанных выше метаболитов, поэтому E. coli часто сосуществует с микроорганизмами, потребляющими водород — например, с метаногенами или бактериями, восстанавливающими сульфат[14].
Оптимальный рост достигается культурами E. coli при температуре 37°C, некоторые штаммы могут делиться при температурах до 49°C[15]. Рост может стимулироваться аэробным или анаэробным дыханием, различными парами окислителей и восстановителей, в том числе, окислением пирувата, формиата, водорода, аминокислот, а также восстановлением кислорода, нитрата, диметилсульфоксида и триметиламин N-оксида[16].
Штаммы, имеющие жгутики, способны передвигаться. Жгутики расположены перитрихиально[17]. На конце жгутика расположен белок FimH, который прикрепляется к молекулам сахаров на поверхности, а сам жгутик состоит из цепочки взаимосвязанных белковых сегментов, закрученных в форме тонкой длинной пружины и упруго вытягивающихся при воздействии силы[18][19].
E. coli в норме заселяет кишечник новорождённого ребёнка в течение 40 часов после рождения, поступая с пищей или от лиц, контактирующих с ребёнком, и сохраняются на протяжении жизни на уровне 106—108 КОЕ/г содержимого толстой кишки. В ЖКТ кишечные палочки прилипают к слизистым оболочкам и являются основными представителями факультативных анаэробов у человека. Так как кишечные палочки не имеют бактериофагов, кодирующих факторы вирулетности, они являются комменсалами[20]. По другим данным, микроорганизмы (в том числе E. coli) начинают заселять человеческий организм ещё в утробе матери[21].
Непатогенный штамм Escherichia coli Nissle 1917 известен как Mutaflor и используется в медицине в качестве пробиотика, в основном для лечения желудочно-кишечных заболеваний, в том числе у новорождённых[22][23].
E. coli часто используют в качестве модельного организма в микробиологических исследованиях. Культивируемые штаммы, например, E. coli K12 хорошо приспособлены к росту в лабораторных условиях, и, в отличие от штаммов дикого типа, неспособны заселять кишечник. Многие лабораторные штаммы утеряли способность образовывать биологические плёнки[24][25]. Описанные особенности предохраняют штаммы дикого типа от антител и химических агентов, но требуют больших затрат вещества и энергии.
В 1946 году Джошуа Ледерберг и Эдуард Тейтем описали явление конъюгации бактерий, используя кишечную палочку в качестве модельного организма[26]. E. coli остаётся одной из наиболее востребованных бактерий при изучении конъюгации и в настоящее время. E. coli была важным компонентом первых экспериментов по генетике бактериофагов[27], ранние исследователи, например, Сеймор Бензер, использовали E. coli и фаг T4 для изучения структуры генов[28]. До исследований Бензера не было известно, имеет ген линейную или разветвлённую структуру.
Кишечная палочка E. coli была одним из первых организмов, чей геном был полностью секвенирован. Последовательность нуклеотидов в геноме штамма К12 E. coli была опубликована в журнале Science в 1997 году[29].
Долговременный эксперимент по эволюции E. coli был начат Ричардом Ленски в 1988 году и позволил непосредственно наблюдать эволюционные изменения в лабораторных условиях[30]. В данном эксперименте одна популяция E. coli получила возможность аэробно метаболизировать цитрат. Такая способность встречается у E. coli в норме крайне редко. Неспособность к росту в аэробных условиях используют для того, чтобы отличить E. coli от других родственных бактерий, например, Salmonella. В ходе данного эксперимента в лабораторных условиях удалось наблюдать процесс видообразования.
E. coli играет важную роль в современной промышленной микробиологии и биологической инженерии[31]. Работа Стенли Нормана Коэна и Герберта Бойера на E. coli с использованием плазмид и эндонуклеаз рестрикции для создания рекомбинантной ДНК находится у истоков современной биотехнологии[32].
Кишечную палочку считают универсальным организмом для синтеза чужеродных белков[33]. В E. coli исследователи вводят гены при помощи плазмид, что позволяет осуществлять биосинтез белков для промышленной ферментации. Также разработаны системы для синтеза в E. coli рекомбинантных белков. Одним из первых примеров использования технологии рекомбинантных ДНК является синтез аналога инсулина человека[34]. Модифицированные E. coli используют при разработке вакцин, синтеза иммобилизованных ферментов и решения других задач[33]. Однако в организме E. coli невозможно получать некоторые крупные белковые комплексы, содержащие дисульфидные связи, в частности, белки, для проявления биологической активности которых требуется посттрансляционная модификация[31].
Гены кишечной палочки также используются для генетической модификации растений, в частности из нее выделяют ген устойчивости к антибиотикам неомицину и канамицину.[35]
Непатогенные бактерии E. coli, в норме в больших количествах населяющие кишечник, могут, тем не менее, вызвать развитие патологии при попадании в другие органы или полости человеческого тела. Если бактерия попадает через отверстие в ЖКТ в брюшную полость, может возникнуть перитонит. Попав и размножившись во влагалище женщины, бактерия может вызвать или осложнить кольпит. Попадание бактерии в предстательную железу мужчины может быть патогенезом острого или хронического бактериального простатита. В таких случаях в лечение включается применение антибиотиков, проводимое таким образом, чтобы не подавлять нормальную микрофлору кишечника, иначе возможно развитие дисбактериоза.
E. coli очень чувствительна к таким антибиотикам, как стрептомицин или гентамицин. Однако E. coli может быстро приобретать лекарственную устойчивость[36].
Вирулентные штаммы E. coli в норме отсутствуют в кишечнике, и заболевание наступает при заражении алиментарным путём. Передача патогенных E. coli часто происходит фекально-оральным путём[20][37][38]. Частые пути передачи могут быть вызваны: низкой гигиеной приготовления пищи[37], загрязнением продуктов навозом[39], поливом урожая загрязнённой водой или сточными водами[40], при выпасе диких свиней на пашнях[41], употреблением для питья воды, загрязнённой сточными водами[42].
Вирулентные штаммы E. coli могут вызывать гастроэнтериты, воспаления мочеполовой системы, а также менингит у новорождённых. В редких случаях вирулентные штаммы также вызывают гемолитический-уремический синдром, перитонит, мастит, сепсис и грамотрицательную пневмонию.
Низкотемпературная электронная микрофотография кластера E. coli. Увеличение в 10 000 раз. Индивидуальные бактерии представлены округлёнными цилиндрами.Некоторые штаммы E. coli, например, O157:H7, O121, O104:h5 и O104:h31, синтезируют потенциально смертельные токсины. Пищевые отравления, инфекционным агентом при которых являются вирулентные E. coli, обычно вызваны употреблением в пищу немытых овощей или непрожаренного мяса.
Первичными резервуарами E. coli O157:H7 является мясной и молочный скот[43], который может переносить бактерии бессимптомно и выделять с фекалиями[43].
В случае заболеваний кишечника у новорождённых, при болезни Крона и при неспецифическом язвенном колите обнаруживают повышенные уровни E. coli в слизистых ЖКТ[44]. Инвазивные штаммы E. coli обнаружены в воспалённых тканях, а количество бактерий в очагах воспаления коррелирует с тяжестью воспаления в кишечнике[45].
Один из серотипов Escherichia coli содержит антиген K1. Заселение кишечника новорождённого данным серотипом бактерий при попадании бактерий из влагалища матери может приводить к менингиту. В отсутствие IgM от матери, которые не способны проникать через гемато-плацентарный барьер, и потому, что организм распознаёт K1 как собственный антиген, данный серотип вызывает тяжёлые воспаления мозга.
Терапия бактериофагами для лечения патогенных бактерий была разработана более 80 лет назад в Советском Союзе, где использовалась для лечения диареи, вызванной E. coli[46]. В настоящее время фаговая терапия доступна лишь в Центре фаговой терапии в Грузии и в Польше[47].
Бактериофаг Т4 является хорошо изученным фагом, инфицирующим E. coli.
Исследователи разрабатывают эффективные вакцины для снижения количества случаев заражения патогенными штаммами E. coli по всему миру[48].
В апреле 2009 года исследователи Мичиганского университета заявили о том, что разработали вакцину для одного из штаммов E. coli. Подана заявка на патент[49].
- ↑ Escherichia coli O157:H7 (неопр.). CDC Division of Bacterial and Mycotic Diseases. Дата обращения 25 января 2007. Архивировано 5 июля 2012 года.
- ↑ Vogt R.L., Dippold L. Escherichia coli O157:H7 outbreak associated with consumption of ground beef, June-July 2002 (англ.) // Public Health Rep : journal. — 2005. — Vol. 120, no. 2. — P. 174—178. — PMID 15842119.
- ↑ Bentley R., Meganathan R. Biosynthesis of vitamin K (menaquinone) in bacteria (англ.) // Microbiology and Molecular Biology Reviews (англ.)русск. : journal. — American Society for Microbiology (англ.)русск., 1982. — 1 September (vol. 46, no. 3). — P. 241—280. — PMID 6127606.
- ↑ Hudault S., Guignot J., Servin A.L. Escherichia coli strains colonising the gastrointestinal tract protect germfree mice against Salmonella typhimurium infection (англ.) // Gut : journal. — 2001. — July (vol. 49, no. 1). — P. 47—55. — DOI:10.1136/gut.49.1.47. — PMID 11413110.
- ↑ Reid G., Howard J., Gan B.S. Can bacterial interference prevent infection? (неопр.) // Trends Microbiol.. — 2001. — September (т. 9, № 9). — С. 424—428. — DOI:10.1016/S0966-842X(01)02132-1. — PMID 11553454.
- ↑ 1 2 3 Feng P, Weagant S, Grant, M. Enumeration of Escherichia coli and the Coliform Bacteria (неопр.) (недоступная ссылка). Bacteriological Analytical Manual (8th ed.). FDA/Center for Food Safety & Applied Nutrition (1 сентября 2002). Дата обращения 25 января 2007. Архивировано 29 ноября 2001 года.
- ↑ 1 2 Thompson, Andrea. E. coli Thrives in Beach Sands, Live Science (4 июня 2007). Дата обращения 3 декабря 2007.
- ↑ Escherichia (неопр.). Taxonomy Browser. NCBI. Дата обращения 30 ноября 2007.
- ↑ Lawrence, J.G. and Ochman, H. (1998) Molecular archaeology of the Escherichia coli genome Proc. Natl. Acad. Sci. USA 95:9413-9417 PMC21352
- ↑ 1 2 Nataro J.P., Kaper J.B. Diarrheagenic Escherichia coli (англ.) // Microbiology and Molecular Biology Reviews (англ.)русск.. — American Society for Microbiology (англ.)русск., 1998. — January (vol. 11, no. 1). — P. 142—201. — PMID 9457432.
- ↑ Viljanen M.K., Peltola T., Junnila S.Y., et al. Outbreak of diarrhoea due to Escherichia coli O111:B4 in schoolchildren and adults: association of Vi antigen-like reactivity (англ.) // The Lancet : journal. — Elsevier, 1990. — October (vol. 336, no. 8719). — P. 831—834. — DOI:10.1016/0140-6736(90)92337-H. — PMID 1976876.
- ↑ Facts about E. coli: dimensions, as discussed in bacteria: Diversity of structure of bacteria: — Britannica Online Encyclopedia (неопр.) (недоступная ссылка). Дата обращения 24 ноября 2010. Архивировано 23 августа 2010 года.
- ↑ Kubitschek H.E. Cell volume increase in Escherichia coli after shifts to richer media (англ.) // American Society for Microbiology (англ.)русск. : journal. — 1990. — 1 January (vol. 172, no. 1). — P. 94—101. — PMID 2403552.
- ↑ Madigan M. T., Martinko J. M. Brock Biology of microorganisms (неопр.). — 11th. — Pearson, 2006. — ISBN 0-13-196893-9.
- ↑ Fotadar U., Zaveloff P., Terracio L. Growth of Escherichia coli at elevated temperatures (англ.) // J. Basic Microbiol. : journal. — 2005. — Vol. 45, no. 5. — P. 403—404. — DOI:10.1002/jobm.200410542. — PMID 16187264.
- ↑ Ingledew W.J., Poole R.K. The respiratory chains of Escherichia coli (англ.) // Microbiology and Molecular Biology Reviews (англ.)русск.. — American Society for Microbiology (англ.)русск., 1984. — Vol. 48, no. 3. — P. 222—271. — PMID 6387427.
- ↑ Darnton NC, Turner L, Rojevsky S, Berg HC, On torque and tumbling in swimming Escherichia coli. J Bacteriol. 2007 Mar;189(5):1756-64. Epub 2006 Dec 22.
- ↑ Жгутики кишечной палочки оказались пружинами с липучками
- ↑ Uncoiling Mechanics of Escherichia coli Type I Fimbriae Are Optimized for Catch Bonds (англ.)
- ↑ 1 2 Evans Jr., Doyle J.; Dolores G. Evans. Escherichia Coli (неопр.). Medical Microbiology, 4th edition. The University of Texas Medical Branch at Galveston. Дата обращения 2 декабря 2007. Архивировано 2 ноября 2007 года.
- ↑ Учёные обнаружили бактерии в кишечнике нерождённых детей — МедНовости — MedPortal.ru
- ↑ Grozdanov L., Raasch C., Schulze J., Sonnenborn U., Gottschalk G., Hacker J., Dobrindt U; Raasch; Schulze; Sonnenborn; Gottschalk; Hacker; Dobrindt. Analysis of the genome structure of the nonpathogenic probiotic Escherichia coli strain Nissle 1917 (англ.) // American Society for Microbiology (англ.)русск. : journal. — American Society for Microbiology (англ.)русск., 2004. — August (vol. 186, no. 16). — P. 5432—5441. — DOI:10.1128/JB.186.16.5432-5441.2004. — PMID 15292145.
- ↑ Kamada N., Inoue N., Hisamatsu T., Okamoto S., Matsuoka K., Sato T., Chinen H., Hong K.S., Yamada T., Suzuki Y., Suzuki T., Watanabe N., Tsuchimoto K., Hibi T; Inoue; Hisamatsu; Okamoto; Matsuoka; Sato; Chinen; Hong; Yamada. Nonpathogenic Escherichia coli strain Nissle1917 prevents murine acute and chronic colitis (англ.) // Inflamm Bowel Dis : journal. — 2005. — May (vol. 11, no. 5). — P. 455—463. — DOI:10.1097/01.MIB.0000158158.55955.de. — PMID 15867585.
- ↑ Fux C.A., Shirtliff M., Stoodley P., Costerton J.W. Can laboratory reference strains mirror «real-world» pathogenesis? (англ.) // Trends Microbiol. : journal. — 2005. — Vol. 13, no. 2. — P. 58—63. — DOI:10.1016/j.tim.2004.11.001. — PMID 15680764.
- ↑ Vidal O., Longin R., Prigent-Combaret C., Dorel C., Hooreman M., Lejeune P. Isolation of an Escherichia coli K-12 mutant strain able to form biofilms on inert surfaces: involvement of a new ompR allele that increases curli expression (англ.) // American Society for Microbiology (англ.)русск. : journal. — 1998. — Vol. 180, no. 9. — P. 2442—2449. — PMID 9573197.
- ↑ Lederberg, Joshua; E.L. Tatum. Gene recombination in E. coli (англ.) // Nature. — 1946. — October 19 (vol. 158). — P. 558. — DOI:10.1038/158558a0. Source: National Library of Medicine — The Joshua Lederberg Papers
- ↑ The Phage Course — Origins (неопр.) (недоступная ссылка). Cold Spring Harbor Laboratory (2006). Дата обращения 3 декабря 2007. Архивировано 20 июля 2002 года.
- ↑ Benzer, Seymour. On the topography of the genetic fine structure (англ.) // Proceedings of the National Academy of Sciences. — National Academy of Sciences, 1961. — March (vol. 47, no. 3). — P. 403—415. — DOI:10.1073/pnas.47.3.403.
- ↑ Frederick R. Blattner, Guy Plunkett III, Craig Bloch, Nicole Perna, Valerie Burland, Monica Riley, Julio Collado-Vides, Jeremy Glasner, Christopher Rode, George Mayhew, Jason Gregor, Nelson Davis, Heather Kirkpatrick, Michael Goeden, Debra Rose, Bob Mau, Ying Shao. The complete genome sequence of Escherichia coli K-12 (англ.) // Science. — 1997. — September 5 (vol. 277, no. 5331). — P. 1453—1462. — DOI:10.1126/science.277.5331.1453.
- ↑ Bacteria make major evolutionary shift in the lab New Scientist
- ↑ 1 2 Lee S.Y. High cell-density culture of Escherichia coli (неопр.) // Trends Biotechnol.. — 1996. — Т. 14, № 3. — С. 98—105. — DOI:10.1016/0167-7799(96)80930-9. — PMID 8867291.
- ↑ Russo E. The birth of biotechnology (англ.) // Nature. — 2003. — January (vol. 421, no. 6921). — P. 456—457. — DOI:10.1038/nj6921-456a. — PMID 12540923.
- ↑ 1 2 Cornelis P. Expressing genes in different Escherichia coli compartments (неопр.) // Curr. Opin. Biotechnol.. — 2000. — Т. 11, № 5. — С. 450—454. — DOI:10.1016/S0958-1669(00)00131-2. — PMID 11024362.
- ↑ Tof, Ilanit Recombinant DNA Technology in the Synthesis of Human Insulin (неопр.). Little Tree Pty. Ltd. (1994). Дата обращения 30 ноября 2007. Архивировано 5 июля 2012 года.
- ↑ Event Name: MON801 (MON80100)
- ↑ Gene Sequence Of Deadly E. Coli Reveals Surprisingly Dynamic Genome (неопр.). Science Daily (25 января 2001). Дата обращения 8 февраля 2007. Архивировано 5 июля 2012 года.
- ↑ 1 2 Retail Establishments; Annex 3 — Hazard Analysis (неопр.). Managing Food Safety: A Manual for the Voluntary Use of HACCP Principles for Operators of Food Service and Retail Establishments. U.S. Department of Health and Human Services Food and Drug Administration Center for Food Safety and Applied Nutrition (April 2006). Дата обращения 2 декабря 2007. Архивировано 7 июня 2007 года.
- ↑ Gehlbach, S.H.; J.N. MacCormack, B.M. Drake, W.V. Thompson. Spread of disease by fecal-oral route in day nurseries (англ.) // Health Service Reports : journal. — 1973. — April (vol. 88, no. 4). — P. 320—322. — PMID 4574421.
- ↑ Sabin Russell. Spinach E. coli linked to cattle; Manure on pasture had same strain as bacteria in outbreak, San Francisco Chronicle (13 октября 2006). Дата обращения 2 декабря 2007.
- ↑ Heaton J.C., Jones K. Microbial contamination of fruit and vegetables and the behaviour of enteropathogens in the phyllosphere: a review (англ.) // J. Appl. Microbiol. : journal. — 2008. — March (vol. 104, no. 3). — P. 613—626. — DOI:10.1111/j.1365-2672.2007.03587.x. — PMID 17927745. (недоступная ссылка)
- ↑ Thomas R. DeGregori. CGFI: Maddening Media Misinformation on Biotech and Industrial Agriculture (неопр.) (недоступная ссылка) (17 августа 2007). Дата обращения 8 декабря 2007. Архивировано 13 октября 2007 года.
- ↑ Chalmers, R.M.; H. Aird, F.J. Bolton. Waterborne Escherichia coli O157 (неопр.) // Society for Applied Microbiology Symposium Series. — 2000. — № 29. — С. 124S—132S. — PMID 10880187.
- ↑ 1 2 Bach, S.J.; T.A. McAllister, D.M. Veira, V.P.J. Gannon, and R.A. Holley. Transmission and control of Escherichia coli O157:H7 (англ.) // Canadian Journal of Animal Science : journal. — 2002. — Vol. 82. — P. 475—490. (недоступная ссылка)
- ↑ Rolhion N., Darfeuille-Michaud A. Adherent-invasive Escherichia coli in inflammatory bowel disease (англ.) // Inflamm. Bowel Dis. : journal. — 2007. — Vol. 13, no. 10. — P. 1277—1283. — DOI:10.1002/ibd.20176. — PMID 17476674.
- ↑ Baumgart M., Dogan B., Rishniw M., et al. Culture independent analysis of ileal mucosa reveals a selective increase in invasive Escherichia coli of novel phylogeny relative to depletion of Clostridiales in Crohn’s disease involving the ileum (англ.) // ISME J : journal. — 2007. — Vol. 1, no. 5. — P. 403—418. — DOI:10.1038/ismej.2007.52. — PMID 18043660.
- ↑ Therapeutic use of bacteriophages in bacterial infections (неопр.) (недоступная ссылка). Polish Academy of Sciences. Архивировано 8 февраля 2006 года.
- ↑ Medical conditions treated with phage therapy (неопр.). Phage Therapy Center. Архивировано 5 июля 2012 года.
- ↑ Girard M., Steele D., Chaignat C., Kieny M. A review of vaccine research and development: human enteric infections (англ.) // Vaccine (англ.)русск. : journal. — Elsevier, 2006. — Vol. 24, no. 15. — P. 2732—2750. — DOI:10.1016/j.vaccine.2005.10.014. — PMID 16483695.
- ↑ Researchers develop E. coli vaccine
