Инфекции, вызываемые стафилококками
Стафилококки хорошо известны как возбудители гнойно-септических инфекций у человека и животных. Наряду с представителями семейства Enterobacteriaceae они занимают ведущее место в этиологии гнойных заболеваний. Род Staphylococcus включает в себя 35 различных видов. В зависимости от способности продуцировать коагулазу, фермент, вызывающий коагуляцию плазмы крови, они подразделяются на две группы: коагулазопозитивные и коагулазонегативные. Место обитания стафилококков – человек и теплокровных животные, внешняя среда. Локализация у человека – кожа и слизистые оболочки, толстый кишечник. Источником стафилококковых инфекций является больной человек или здоровый носитель. Пути передачи: воздушно-капельный, воздушно-пылевой, контактный, пищевой. Восприимчивость к инфекции зависит от общего состояния организма и возраста. Наиболее восприимчивы дети, особенно новорожденные и грудного возраста. В норме способность стафилококка к инвазии и резистентность хозяина хорошо сбалансированы, поэтому инфекция не развивается, пока не создастся ситуация, когда встречаются высоковирулентный микроорганизм или макроорганизм со сниженной резистентностью.
Наиболее известным представителем коагулазопозитивных стафилококков является S.aureus (золотистый стафилококк). Он встречается в передних отделах носовых ходов у 20–40% здоровых взрослых людей. Приблизительно у 1/3 населения он постоянно выделяется из носа, у 1/3 отмечается транзиторное носительство и 1/3 свободна от носительства. S.aureus наиболее часто выделяется при гнойной патологии, вызывает целый ряд заболеваний: фолликулиты, фурункулы и карбункулы, гидроадениты, маститы, раневые инфекции, бактериемии и эндокардиты, менингиты, перикардиты, легочные инфекции, остеомиелиты и артриты, гнойные миозиты, пищевые отравления, синдром токсического шока. Упомянутые заболевания обусловливаются факторами патогенности: капсульными полисахаридами, пептидогликанами и тейхоевыми кислотами, протеином А, ферментами, гемолизинами, токсинами (эксфолиативный, энтеротоксины от А до Е, Н и I), суперантигеном, который принадлежит к энтеротоксину (TSST-1), вызывающему токсический шок синдром.
Все остальные коагулазопозитивные стафилококки выделяются в основном от животных и редко от человека, но в отдельных случаях могут вызывать у человека гнойно-воспалительные заболевания.
Среди коагулазонегативных стафилококков наиболее значимы в патологии человека S.epidermidis и S.saprophyticus. Они могут вызывать инфекции мочевыводящих путей, остеомиелиты, бактериемии, инфекции у новорожденных детей в палатах интенсивной терапии, заболевания глаз, кожные инфекции, поражают клапаны сердца, вызывают гнойные воспаления при операции по замене сердечных клапанов на искусственные, при шунтирование органов, использование внутривенных катетеров, катетеров при гемодиализе, а также при ангиопластике.
В настоящее время микроорганизмы рода Staphylococcus играют лидирующую роль среди возбудителей внутрибольничных инфекций. До определенного времени пенициллин был основным препаратом выбора при лечении тяжелых гнойных инфекций вызываемых S. aureus. Затем стали появляться штаммы устойчивые к этому антибиотику. Оказалось, что устойчивость к пенициллину была обусловлена продукцией фермента .-лактамазы разрушающей β-лактамное кольцо в молекуле пенициллина. В настоящее время около 80% изолируемых штаммов
aureus. Затем стали появляться штаммы устойчивые к этому антибиотику. Оказалось, что устойчивость к пенициллину была обусловлена продукцией фермента .-лактамазы разрушающей β-лактамное кольцо в молекуле пенициллина. В настоящее время около 80% изолируемых штаммов 
 В отличие от антибиотиков они не подавляют рост нормальной симбиотической микрофлоры человека и не приводят к дисбактериозам. Тем не менее, нужно имеет в виду, что фаги также вызывают развитие резистентности у стафилококков, поэтому перед их использованием, как и перед применением антибиотиков, необходимо проверять чувствительность к ним у изолируемых штаммах стафилококков.
В отличие от антибиотиков они не подавляют рост нормальной симбиотической микрофлоры человека и не приводят к дисбактериозам. Тем не менее, нужно имеет в виду, что фаги также вызывают развитие резистентности у стафилококков, поэтому перед их использованием, как и перед применением антибиотиков, необходимо проверять чувствительность к ним у изолируемых штаммах стафилококков.Материал для исследований. Кровь, СМЖ, гной, раневое отделяемое, грудное молоко, мазки из носа; смывы c медицинского оборудования и инвентаря.
Этиологическая лабораторная диагностика включает
Сравнительная характеристика методов лабораторной диагностики, показания к применению различных лабораторных исследований. Техника выделения возбудителя в настоящее время хорошо отработана. Микроорганизмы довольно устойчивы к факторам внешней среды, поэтому если отобранный биологический материал невозможно сразу использовать для исследования, можно воспользоваться специальными контейнерами и траспортными средами. Подробнее техника отбора и транспортировки биологического материала в клинико- диагностическую лабораторию описана в разделе преаналитические этапы исследования. Для выделения возбудителя, как правило, достаточно 3–4 дня. Исключением является выделение стафилококков из крови. В этом случае успех техники во многом будет зависеть от правильного выбора времени для отбора крови и присутствия в крови пациентов антибактериальных препаратов.
Микроорганизмы довольно устойчивы к факторам внешней среды, поэтому если отобранный биологический материал невозможно сразу использовать для исследования, можно воспользоваться специальными контейнерами и траспортными средами. Подробнее техника отбора и транспортировки биологического материала в клинико- диагностическую лабораторию описана в разделе преаналитические этапы исследования. Для выделения возбудителя, как правило, достаточно 3–4 дня. Исключением является выделение стафилококков из крови. В этом случае успех техники во многом будет зависеть от правильного выбора времени для отбора крови и присутствия в крови пациентов антибактериальных препаратов.
Особенности интерпретации результатов лабораторных исследований. При исследовании стерильного биологического материала (кровь, СМЖ) клиническое значение имеет обнаружение
Гемолитический стафилококк: патогенность, лечение, морфология
Что такое стафилококки?Стафилококки — распространённое семейство бактерий, повсеместно встречающихся в природе. Некоторые виды входят в состав естественной микрофлоры человека, другие же являются условно-патогенными, третьи — представляют собой исключительно опасные возбудители широкого спектра инфекционных заболеваний.
Некоторые виды входят в состав естественной микрофлоры человека, другие же являются условно-патогенными, третьи — представляют собой исключительно опасные возбудители широкого спектра инфекционных заболеваний.
Staphylococcus haemolyticus принадлежит к семейству стафилококков, название этого вида происходит от его особенности — способности разрушать эритроциты крови человека.
Пожалуй, нет уголка в человеческом организме, где не мог бы поселиться представитель из данного семейства бактерий: носоглотка, дыхательные пути, кишечник, кожные покровы, органы мочевыводящей системы. Как правило, условно-патогенные формы стафилококков не вызывают каких-либо болезненных проявлений, но стоит иммунитету упасть, или бактерии попасть в те места, где её быть ни в коем случае не должно, как микроб даст о себе знать.
Перечень болезней, вызываемых этими микроорганизмами довольно велик. К ним относятся ОРЗ, воспалительные процессы различных органов и тканей, гнойные поражения кожных покровов, а также сложно излечимые аутоиммунные заболевания
(ревматоидный артрит, миокардит, васкулит и многие другие).
Стафилококки отличаются высокой природной невосприимчивостью к антибиотикам. Полностью искоренить их из организма практический невозможно, к тому же многие из них приносят немало пользы, участвуя в процессе переваривания пищи и в механизмах естественной защиты организма.
Не стоит лишний раз пугаться по поводу факта носительства тех или иных видов этой бактерии. Соблюдение правил личной гигиены, правильное питание, поддержание крепкого иммунитета, своевременная обработка ран — сведут к минимуму риски возникновения патологических процессов, связанных с присутствием в организме стафилококков.
Как защититься от Стафилококков, пути передачи?
Ввиду высокой распространенности бактерии и относительно невысокой чувствительности к внешней среде, защититься от заражения довольно сложно. Не стоит лишний раз подвергать организм воздействию очередного штамма этой бактерии. Не надейтесь только на сильный иммунитет, профилактика всегда лучше, нежели лечение.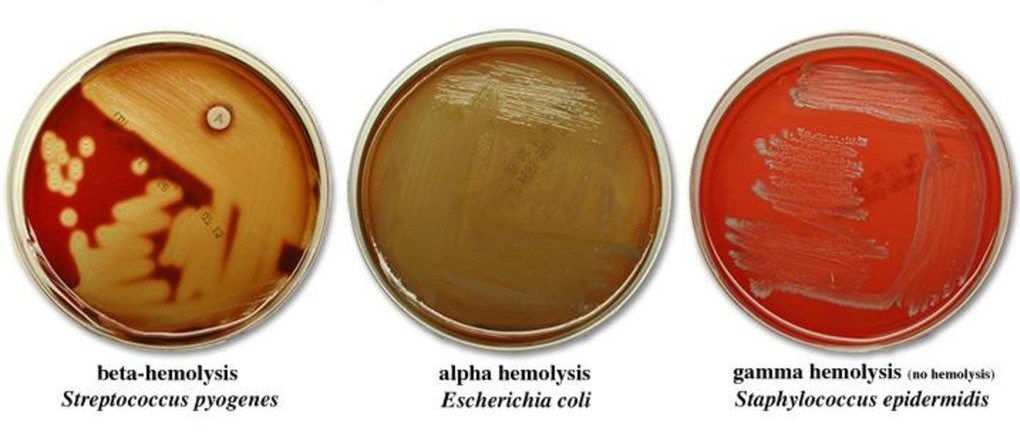
Стафилококки распространяются крайне легко, к путям передачи можно отнести:
- Контактно-бытовой
- Воздушно-капельный
- Пищевой
К мерам предосторожности относятся:
- Кипячение воды для питья
- Хорошая вентиляция помещений
- Своевременное мытьё рук
- Регулярная дезинфекция поверхностей и предметов, используемых в быту
Уделяйте больше внимания детям!
Из-за несформировавшегося иммунитета дети наиболее чувствительны к инфекциям.
Придерживайтесь следующих рекомендаций:
- Своевременная смена памперсов
- Своевременная стирка постельного белья, детской одежды
- Правильная и регулярная дезинфекция детской посуды (соски, бутылочки, пустышки)
- Регулярное купание ребенка
- Мытьё груди перед кормлением
Будьте бдительны! Стоит бережно относиться и к своему здоровью, острые и хронические стафилококковые инфекции некоторых видов могут привести к тяжелым осложнениям. Не пренебрегайте слабовыраженными длительно текущими симптомами. Хроническое воспаление гланд, хронический кашель, регулярные циститы и уретриты — могут свидетельствовать о наличии патологических процессов, связанных, в том числе и со стафилококковыми инфекциями, способными в дальнейшем привести к невосполнимой потере здоровья.
Не пренебрегайте слабовыраженными длительно текущими симптомами. Хроническое воспаление гланд, хронический кашель, регулярные циститы и уретриты — могут свидетельствовать о наличии патологических процессов, связанных, в том числе и со стафилококковыми инфекциями, способными в дальнейшем привести к невосполнимой потере здоровья.
Стафилококки обладают приличной устойчивостью к условиям внешней среды. Они обнаруживаются повсеместно: в воздухе, в земле, в водоёмах, на поверхности предметов. При температуре кипения бактерии погибают моментально, при температуре 65-75°С могут сохраняться до 15 минут. В замороженном виде сохраняются в течении нескольких лет. Практически не чувствительны к высушиванию, но солнечный свет убивает в течении нескольких часов. Малочувствительны к дезинфицирующим средствам, при контакте со многими из них белковая поверхность микроорганизмов мгновенно коагулирует, предотвращая проникновение вещества внутрь клетки. Но всеми известная зелёнка убивает их почти мгновенно.
Стафилококки имеют овальную или шаровидную форму, неподвижны, спор не образуют, факультативно анаэробны, грамположительны. Клетки обычно имеют кокковидную (шарообразную) форму и имеют диаметр от 0,8 до 1,3 мкм. Живут на разнообразных субстратах, включая глюкозу, глицерин, мальтозу, сахарозу и трегалозу. Размножаются путем деления, дочерние клетки могут сохранять связь друг с другом, формируя скопления в виде гроздей винограда, содержащие от двух до нескольких десятков бактерий. При микроскопии биологического материала могут обнаруживаться поштучно или попарно. При росте могут выделять пигменты: золотистый, желтый или белый. Оптимальные условия для роста и развития — температура 37° С и слабощелочные среды с рН 7,2-7,4.
Staphylococcus haemolyticus и человекStaphylococcus haemolyticus или Гемолитический стафилококк — это часть микрофлоры кожи людей. Самые большие популяции можно выявить в подмышечных впадинах, в промежности, паховых областях. Данный вид микроорганизма также может обитать на предметах обихода и колонизировать домашних животных.
Данный вид микроорганизма также может обитать на предметах обихода и колонизировать домашних животных.
Staphylococcus haemolyticus является одним из наиболее клинически исследованным представителем своего семейства. Их опасность характеризуется тем, что они могут вырабатывать токсины и ферменты, обладающие патогенным воздействием для клеток, нарушая в них жизненно важные процессы. Бактерии разрушительно влияют на слизистые оболочки, соединительные ткани, кожные покровы и подкожную клетчатку.
Наряду с золотистым, эпидермальным и сапрофитным, гемолитический стафилококк является широко распространённым внутрибольничными патогенном. Обладая относительно низкой, по сравнению со своими собратьями, патогенностью, представляет опасность лишь при сниженном иммунитете и при проникновении во внутренние среды организма, где может послужить причиной инфекционного процесса.
Инфекции мягких тканей встречаются редко, чаще всего возникают у пациентов с ослабленным иммунитетом в больничных условиях, и как правило, связаны с введением инородных тел в организм человека. Таковыми могут послужить импланты: протезы клапанов сердца, ортопедические протезы, также внутрисосудистые и мочевые катетеры. Существует большой риск занесения патогена в процессе проведения каких либо хирургических вмешательств.
Таковыми могут послужить импланты: протезы клапанов сердца, ортопедические протезы, также внутрисосудистые и мочевые катетеры. Существует большой риск занесения патогена в процессе проведения каких либо хирургических вмешательств.
Гемолитический стафилококк, в случае возникновения осложнений , может вызвать эндокардиты, тяжёлые поражения мочеполовой системы, перитонит, инфекционные процессы постоперационных ран, остеомиелит и поражения суставов, сепсис, токсический шок, нарушения деятельности ЦНС, пневмонии, различные гнойные поражения кожных покровов и подкожной клетчатки.
Гемолитический стафилококк в уретре у мужчин
Нередко S. haemolyticus обнаруживается в результате анализа соскоба уретры или секрета предстательной железы. При отсутствии каких-либо прочих симптомов, как и скрытых так и явных, лишний раз беспокоится не о чём. Существует вероятность загрязнения анализа бактериями находящимися на внешней поверхности половых органов.
Не исключены и случаи заселения уретры условно патогенной микрофлорой кожных покровов и кишечника. Эти бактерии регулярно сменяют друг друга, не вызывая каких либо болезненных проявлений. В то же время, если наблюдаются какие-либо воспалительные процессы мочеполовой системы, в том числе увеличение простаты, гемолитический стафилококк вполне может быть их причиной, в этом случае врачом может быть принято решение о начале лечения.
S. haemolyticus довольно часто является причиной гнойных инфекций мочевыводящих путей как у женщин, так и у мужчин. Особое внимание на наличие в пробах гемолитического стафилококка, даже при отсутствии каких либо проявлений, стоит обратить беременным женщинам и их партнёрам, а также парам собирающимся заводить детей.
Хронические инфекции органов мочеполовой системы могут быть причиной осложнений при беременности, вплоть до выкидыша. Некоторыми исследованиями отмечена повышенная патогенность S. haemolyticus для беременных женщин.
Некоторые штаммы Staphylococcus haemolyticus продуцируют различные типы энтеротоксинов.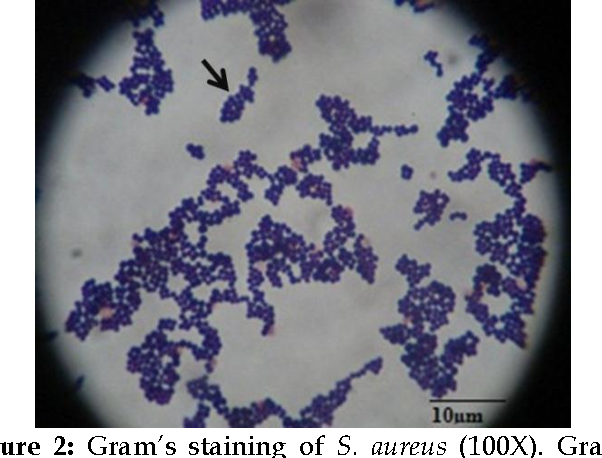 Также в процессе жизнедеятельности могут выделять гемолизины. Не исключена возможность синтеза эксфолиатинов и лейкоцидинов различных типов. В одном из исследований, после анализа 64 штаммов S. haemolyticus отмечалось продуцирование следующих энтеротоксинов.
Также в процессе жизнедеятельности могут выделять гемолизины. Не исключена возможность синтеза эксфолиатинов и лейкоцидинов различных типов. В одном из исследований, после анализа 64 штаммов S. haemolyticus отмечалось продуцирование следующих энтеротоксинов.
- Staphylococcal enterotoxin A (SEA)
- Staphylococcal enterotoxin B (SEB)
- Staphylococcal enterotoxin C (SEC)
- Staphylococcal enterotoxin E (SEE)
Кроме того, было обнаружено, что треть штаммов продуцируют, по меньшей мере, один из вышеперечисленных типов токсинов.
Особенности лечения гемолитического стафилококка
Проблема токсинов заключается в том, что они могут сохранять своё действие и после гибели бактерии источника. Не смотря на фактическое уничтожение возбудителя, энтеротоксины продолжают разрушать организм больного, вызывая ряд тяжёлых симптомов вплоть до токсического шока. В некоторых случаях, токсическое действие усиливается и после начала антибиотикотерапии, как следствие высвобождения токсинов из тел мёртвых бактерий.
Для лечения используются антибактериальные препараты, иммуноглобулины, в редких случаях допускается применение поливалентного стафилококкового бактериофага, а также аутовакцинации.
Антибиотикорезистентность Пример множественной резистентности из реального анализаStaphylococcus haemolyticus имеет один из самых высокую устойчивость к антибиотикам среди прочих стафилококков. большинство штаммов устойчивы к одному или нескольким, если не ко всем из следующих типов антибиотиков:
- пенициллины
- цефалоспорины
- макролиды
- хинолоны
- тетрациклины
- аминогликозиды
- гликопептиды
- фосфомицин
Множественная лекарственная устойчивость встречается довольно часто, что делает терапию инфекций вызванных S. haemolyticus крайне сложной задачей.
Только врач на основе анализа на антибиотикорезистентность может правильно составить лечение! Спонтанное назначение антибиотиков может быть крайне неэффективным и нанести вред здоровью человека!
Структура и Факторы антибиотикорезистентности Клеточная стенкаКак и другие грамположительные микробы, S. haemolyticus имеет толстую, довольно однородную клеточную стенку (60-80 нм), состоящую из пептидогликана, тейхоевой кислоты и белка. Пептидогликан группы A3 является характерной особенностью этого микроба, два преобладающих перекрестных мостика представляют собой COOH-Gly-Gly- Ser-Gly-Gly-Nh3 и COOH-Ala-Gly-Ser-Gly-Gly-Nh3. Изменения этих перекрестных мостиков обуславливают устойчивостью к гликопептидам.
Формирование КапсулыНекоторые штаммы Staphylococcus haemolyticus способны образовывать капсулу поверх клеточной стенки, дополнительно защищая бактерию от внешних факторов.
Формирование биопленкиСпособность бактерии прилипать к медицинским устройствам и в дальнейшем формировать биопленки является основным фактором вирулентности. Также образование биопленкок усиливается в случае присутствия в среде некоторых антибиотиков, вследствии чего, к ним повышается устойчивость и довольно часто болезнь переходит в вялотекущую или персистирующую форму.
Преобразование в L-формуСпособность частично или полностью лишаться клеточной стенки, но при этом сохранять жизнедеятельности — является одним из факторов выживания в средах с присутствием антибиотиков, механизм действия которых направленным на разрушение клеточной стенки.
ИммунитетСильный иммунитет представляет собой максимально эффективный барьер, препятствующий развитию многих инфекционных заболеваний. Кожные покровы препятствуют проникновению микроорганизма в кровь. При проникновении патогена в ЖКТ, кислотность желудка и наличие естественной конкурирующей микрофлоры в кишечнике не даёт незваным гостям развиться. В связи с этим, стафилококки чаще развиваются на фоне пониженного иммунитета, могут возникнуть параллельно с ОРЗ, как следствие неправильного и частого применения антибиотиков или других лекарственных препаратов, разрушающих естественные барьеры организма.
Вакцинация
Существует также ряд экспериментальных и малоэффективных вакцин. Низкая эффективность прививок связана с большой разновидностью штаммов микроорганизмов. По этой же причине естественный иммунитет не всегда способен дать соответствующий отпор захватчикам.
Стафилококковая инфекция
«Стафилококк» — это сокращенное название распространенной бактерии, которая называется «золотистый стафилококк». Бактерии стафилококка часто присутствуют на коже, не вызывая инфекции. Инфекция развивается, если они проникают под кожу. Это вызывает покраснение, болезненную чувствительность, отекание и иногда жидкие выделения.
МРЗС означает «метициллин-резистентный золотистый стафилококк» («Methicillin-Resistant Staph Aureus») В отличие от обычной стафилококковой инфекции, бактерии МРЗС устойчивы к воздействию обычных антибиотиков (antibiotics) и сложнее поддаются лечению. Кроме того, бактерии МРЗС более токсичны, чем обычные бактерии стафилококка. Они могут быстро распространяться в организме и вызывать опасное для жизни заболевание.
МРЗС передается при непосредственном физическом контакте с бактериями. МРЗС также передается через предметы, зараженные человеком, являющимся носителем бактерий, такие как повязки, полотенца, постельное белье или спортивный инвентарь. Обычно бактерии не передаются через воздух. Однако они могут передаваться при непосредственном контакте с жидкостью, выделяемой при кашле или чихании. Если у вас кожная инфекция МРЗС, существует риск рецидива в будущем.
При подозрении на инфекцию МРЗС врач может сделать посев выделений из раны (wound culture) для подтверждения диагноза. При наличии абсцесса он может быть дренирован. Вероятно, вам будет назначен один или несколько антибиотиков, которые действуют на МРЗС.
Уход в домашних условиях
Принимайте антибиотики в точном соответствии с назначением. Даже если вы почувствовали себя лучше, не прекращайте принимать их, пока они не закончатся, или до тех пор, пока не получите указание прекратить их прием от своего лечащего врача.
Если вам была назначена мазь с антибиотиком, применяйте ее в соответствии с полученными указаниями.
В течение 5 дней ежедневно мойте все тело (от волосистой части головы до пальцев ног) специальным мылом. Два раза в день чистите ногти пальцев рук в течение 1 минуты щеткой со специальным мылом.
Раны должны быть закрыты чистыми и сухими повязками. Если повязки загрязнились, их необходимо заменить. Каждый раз, когда вы меняете повязку или касаетесь раны, тщательно мойте руки.
Если у вас наращенные ногти или лак на ногтях, их необходимо снять.
Лечение членов семьи
Если у вас диагностировано возможное заражение инфекцией МЗРМ, ваши близкие, живущие вместе с вами, подвержены более высокому риску наличия бактерий на коже или в носу, даже при отсутствии признаков инфекции. Бактерии необходимо удалить с кожи всех членов семьи одновременно, чтобы они не передавались от одного к другому. Проинструктируйте их, как следует удалить бактерии:
Члены семьи должны использовать специальное мыло, как описано выше.
Если у кого-либо из членов семьи имеется кожная инфекция, ее должен лечить врач. Чтобы вылечить инфекцию МРЗС, мытья не достаточно.
Очистите столешницы и детские игрушки.
Каждый член семьи должен пользоваться только своими предметами личного обихода, такими как зубные щетки или бритвенные станки. При этом пользоваться общими очками, тарелками и столовыми приборами разрешается.
Предотвращение распространения инфекции.
Часто мойте руки простым мылом и теплой водой. Обязательно очищайте зоны под ногтями, между пальцами и запястья. Вытирайте руки одноразовыми полотенцами (например, бумажными). Если нет возможности воспользоваться мылом и водой, можно использовать антисептик для рук на основе спирта. Втирайте антисептик по всей поверхности рук, пальцев и запястий до полного высыхания.
Не пользуйтесь чужими предметами личного обихода, такими как полотенца, бритвенные станки, одежда или униформа. Стирайте постельное белье, полотенца и одежду в горячей воде со стиральным порошком. Устанавливайте для сушилки режим высокой температуры, чтобы убить оставшиеся бактерии.
Если вы посещаете тренажерный зал, до и после каждого применения протирайте инвентарь антисептиком на основе спирта. Также протирайте все ручки и места, за которые беретесь руками.
Если вы занимаетесь спортом, после каждой тренировки принимайте душ с обычным мылом. Каждый раз после душа используйте чистое полотенце.
Последующее наблюдение
Приходите на контрольные приемы, назначенные вашим врачом, или в соответствии с указаниями, полученными от наших сотрудников. Если был сделан посев выделений из раны, получите результаты в указанное время. Если в ваш курс лечения будут внесены какие-либо изменения, вам о них сообщат.
Если у вас был диагностирован МРЗС, в будущем вам необходимо будет сообщать медицинскому персоналу о том, что вы проходили лечение от этой инфекции.
Когда необходимо обратиться за медицинской помощью
В любом из следующих случаев обратитесь в обслуживающее вас медицинское учреждение:
Усиливающееся покраснение, опухание или боль
Красные полосы в коже вокруг раны
Слабость или головокружение
Появление гноя или выделений из раны
Температура выше 100,4 ºF (38,0 ºС) или в соответствии с указаниями вашего лечащего врача
| Исследуемый материал | Допустимые м/о | Возбудители гнойно-воспалительных заболеваний | Степень роста |
| Отделяемое из носа |
Staphylococcus epidermidis Streptococcus viridans |
Staphylococcus aureus Staphylococcus haemolyticus Streptococcus pyogenes Streptococcus pneumoniae Pseudomonas aeruginosa Escherichia coli p. Enterobacetr р. Klebsiella р. Citrobacter p. Proteus p. Candida p. Corynebacterium p. Actinomyces p. Neisseria |
I- 102КОЕ II – 103КОЕ III – 104 КОЕ IV- 105 — 106 КОЕ I,II–контаминация или носительство III, IV – этиологическая роль возбудителя |
| Отделяемоеиззева |
Staphylococcus epidermidis Streptococcus viridans |
Staphylococcus aureus Staphylococcus haemolyticus Streptococcus pyogenes Streptococcus pneumoniae Pseudomonas aeruginosa Escherichia coli p. Enterobacter р. Klebsiella р. Citrobacter p. Proteus p. Candida p. Corynebacterium p. Neisseria |
I- 102КОЕ II – 103КОЕ III – 104 КОЕ IV- 105 — 106 КОЕ I,II – контаминация или носительство III, IV – этиологическая роль возбудителя |
| Мокрота |
Staphylococcus epidermidis Streptococcus viridans |
Staphylococcus aureus Staphylococcus haemolyticus Streptococcus pyogenes Streptococcus pneumoniae Escherichia coli p. Enterobacter Pseudomonas aeruginosa р.Klebsiella р. Citrobacter p. Proteus p. Candida p. Corynebacterium p. Actinomyces p. Neisseria |
I- 102КОЕ/мл II – 103КОЕ/мл III – 104 КОЕ/мл IV- 105 — 106 КОЕ/мл I –контаминация II, III, IV – этиологическая роль возбудителя |
| Отделяемое из глаз |
Staphylococcus epidermidis Corynebacterium xerosis Corynebacterium pseudodiphteriticum (единичные колонии) |
Staphylococcus aureus Staphylococcus epidermidis Neisseria gonorrhoeae Corynebacteriumn diphteritiae Streptococcus pyogenes Streptococcus viridans Staphylococcus haemolyticus Pseudomonas aeruginosa Escherichia coli p. Enterobacter р. Klebsiella р. Citrobacter p. Proteus p. Candida p. Aspergillus Возбудители только воспалений коньюктивы Haemophilusaegypticus Moraxella lacunata Branhamella catarrhalis |
I- 102КОЕ II – 103КОЕ III – 104 КОЕ IV- 105 — 106 КОЕ I –контаминация II, III, IV – этиологическая роль возбудителя |
|
Отделяемое из ушей Наружное ухо |
Staphylococcus epidermidis Corynebacterium pseudodiphteriticum
|
Staphylococcus aureus Staphylococcus epidermidis Streptococcus pyogenes Streptococcus viridans Staphylococcus haemolyticus Escherichia coli Прихроническойинфекции: p. Enterobacter р. Pseudomonas р. Klebsiella р. Citrobacter p. Proteus p. Candida p. Corynebacterium p. Actinomyces p. Aspergillus |
I- 102КОЕ II – 103КОЕ III – 104 КОЕ IV- 105 — 106 КОЕ I –контаминация II, III, IV – этиологическая роль возбудителя |
|
Отделяемое из ушей среднее и внутреннее ухо |
М/о отсутствуют |
Staphylococcus epidermidis Corynebacterium pseudodiphteriticum Staphylococcus aureus Staphylococcus epidermidis Streptococcus pyogenes Streptococcus viridans Staphylococcus haemolyticus Escherichia coli Прихроническойинфекции: p. Enterobacter р. Pseudomonas р. Klebsiella р. Citrobacter p. Proteus p. Candida p. Corynebacterium p. Actinomyces p. Aspergillus |
I- 102КОЕ II – 103КОЕ III – 104 КОЕ IV- 105 — 106 КОЕ |
| Моча |
Стерильна После прохождения через мочеиспускательній канал может обнаруживаться в норме :Staphylococcusepidermidis p. Enterococcus |
Escherichia coli p. Enterobacter p. Enterococcus Pseudomonas aeruginosa p. Proteus р.Klebsiella р. Citrobacter Staphylococcus aureus Staphylococcus epidermidis (> II ст.р.) Streptococcus pyogenes p. Mycoplasma p. Ureaplasma p. Candida
|
I- 103КОЕ/мл II –3 . 103 — 5 . 103 КОЕ/мл III – 104– 5 . 104КОЕ/мл IV- 105 — 106КОЕ/мл
I –контаминация II – исследование следует повторить III, IV – этиологическая роль возбудителя
при низком удельном весе, рН< 5 , лейкоцитозе, плохом оттоке мочи – может наблюдаться низкая степень бактеириурии, при имеющимся заболевании, необходимо определить вид микроорганизмов Pseudomonas aeruginosa p. Proteus р.Klebsiella р. Citrobacter Escherichiacoli- чаще всего вызывают уроинфекции Монокультура – острый воспалительный процесс Ассоциации – при хронической (часто низкая степень бактериурии) |
| Уретра |
Staphylococcusepidermidis p. Enterococcus сем. Enterobacteriaceae Corynebacterium |
Escherichia coli p. Enterobacter p. Enterococcus Pseudomonas aeruginosa p. Proteus р.Klebsiella р. Citrobacter Staphylococcus aureus Staphylococcus epidermidis (> II ст.р.) Streptococcuspyogenes p. Candida
На специальных элективных средах: p. Mycoplasma p. Ureaplasma Патогенные м/о (в посеве не определяются): Neisseria gonorrhoeae Micobacterium tuberculosis Treponema pallida |
I- 102КОЕ II – 103КОЕ III – 104 КОЕ IV- 105 — 106 КОЕ
I –контаминация II – исследование следует повторить III, IV – этиологическая роль возбудителя
|
| Кровь | Стерильна |
Сепсис и бактериимию могут вызвать все м/о патогенные и условно-патогенные: Staphylococcus aureus Staphylococcus epidermidis Neisseria gonorrhoeae Corynebacteriumn diphteritiae Streptococcus pyogenes Streptococcus viridans Staphylococcus haemolyticus Pseudomonas aeruginosa Escherichia coli p. Enterobacter р.Klebsiella р. Citrobacter p. Proteus p. Candida |
Степень не определяется |
| Желчь | Стерильна |
Escherichia coli p. Enterobacter р. Klebsiella р. Citrobacter p. Enterococcus Clostridium perfringens (Staphylococcusaureus– свидетельствует о печеночном или диафрагминальном абсцессе) |
I- 102КОЕ II – 103КОЕ III – 104 КОЕ IV- 105 — 106 КОЕ
I –контаминация II – исследование следует повторить III, IV – этиологическая роль возбудителя
|
| Сперма | Стерильна |
Escherichia coli p. Enterobacter р. Klebsiella р. Citrobacter p. Enterococcus Clostridium perfringens Staphylococcusaureus p. Enterobacter р. Klebsiella р. Citrobacter p. Proteus p. Candida |
I- 102КОЕ II – 103КОЕ III – 104 КОЕ IV- 105 — 106 КОЕ
I –контаминация II – исследование следует повторить III, IV – этиологическая роль возбудителя
|
| Женские половые органы |
Влагалище: в норме у новорожденных – молочнокислые бактерии, которые вытесняются Staphylococcusepidermidis до полового созревания В менопаузеStaphylococcusepidermidis В репродуктивном возрасте – Lactobacillus, Peptostreptococcus, Corynebacterium ( у многих здоровых женщин можно обнаружить Escherichiacoli р.Streptococcus Staphylococcusaureus p. Mycoplasma p. Ureaplasma в низкой степени роста (I ст.р.) !!!! Цервикальный канал: стерилен Полость и придатки матки: стерильныВ слизисто-гнойной пробке влагалища в большом количестве присутсвуют молочнокислые бактерии ( в посеве не определяются)!!!! |
Патогенные м/о (в посеве не определяются): Neisseria gonorrhoeae Micobacterium tuberculosis Treponema pallida Listeria monocytogenes Trichomonasvaginalis Условно-патогенныем/о (определяютсявпосеве): Escherichia coli p. Enterobacter р. Klebsiella р. Citrobacter p. Enterococcus p. Candida р. Streptococcus p. Staphylococcus На специальных элективных средах: p. Mycoplasma p. Ureaplasma Методом ПЦР, РИФ, ИФА р. Chlamidia Показатели баквагиноза: (в посевах не определяются) Gardnerellavaginalis p. Leptothrix
|
I- 102КОЕ II – 103КОЕ III – 104 КОЕ IV- 105 — 106 КОЕ I, II – контаминация III, IV – этиологическая роль возбудителя |
Бакпосев на флору и чувствительность к антибиотикам
Универсальное микробиологическое исследование, позволяющее определить наличие и основные культуральные свойства (титр, количество), чувствительность к основным группам антибактериальных препаратов) большинства аэробных микроорганизмов, растущих на обычных питательных средах. Для исследования подходит практически любой вид биологического материала. Анализ используют для микробиологической диагностики неспецифических инфекционных заболеваний, выявления возбудителей хронических инфекций, определения наиболее подходящего препарата для антибактериальной терапии.4)
Указанные выше микроорганизмы относятся к постоянной нормальной микрофлоре и не требуют лечения антимикробными препаратами, т.к. при их отсутствии могут возникнуть проблемы «дисбактериоза» в указанных органах (снижение местного иммунитета, рецидивы хронических заболеваний) . Лечение этих микроорганизмов антибиотиками сравнимо, с лечением антибиотиками лакто- и бифидобактерий в кишечнике. При обнаружении микробиологическим методом микроорганизмов, составляющих нормальную микрофлору, или условно-патогенных микроорганизмов в титре менее диагностического не определяется чувствительность к антибиотикам и бактериофагам, так как это количество не является значимым и не требует лечения противомикробными препаратами.
Стоимость исследования
Гемолитический стафилококк — Staphylococcus haemolyticus
Виды бактерий
Staphylococcus haemolyticus является членом группы стафилококков, отрицательных по коагулазе (CoNS). Он является частью кожной флоры человека, и его самые большие популяции обычно находятся в подмышечных впадинах , промежности и паховых областях. S. haemolyticus также колонизирует приматов и домашних животных . Это хорошо известный условно-патогенный микроорганизм , второй по частоте выделяемый CoNS ( первый — S. epidermidis ). Инфекции могут быть локальными или системными и часто связаны с введением медицинских устройств . Фенотип с высокой устойчивостью к антибиотикам и способность образовывать биопленки делают S. haemolyticus трудным для лечения патогеном . Его наиболее близкий вид — Staphylococcus borealis .
Биология и биохимия
S. haemolyticus неподвижен, не спорулирует , факультативно анаэробен и грамположителен . Клетки обычно имеют кокковую форму и имеют диаметр 0,8–1,3 мкм. Он живет на самых разных субстратах , включая глюкозу , глицерин , мальтозу , сахарозу и трегалозу . Он также дает положительный результат на продукцию ацетоина, аргинин , дигидролазу, бензидин , каталазу , гемолиз и липазу ; он дает отрицательный результат на коагулазу , ДНКазу , орнитиндекарбоксилазу , фосфатазу , уреазу и оксидазу .
Условия роста
Оптимальный рост происходит при температуре от 30 до 40 ° C в присутствии кислорода и 10% NaCl . Однако некоторые штаммы могут расти при температуре от 18 до 45 ° C. Рост при 15 ° C или 15% NaCl слабый или отсутствует.
Структура генома
В S. haemolyticus штамм JCSC1435 геном содержит 2685015 п.н. хромосому и три плазмиды из 2300 п.н. , 2366 п.н. , и 8,180 пар оснований . Хромосом сравнима по размерам к таковым из золотистого стафилококка и С. эпидермальных и содержит аналогичное содержание G + C . Кроме того, большая часть открытых рамок считывания (ORF) сохраняется у всех трех видов. В среднем ортологичные ORF идентичны на 78%. Однако у S. haemolyticus действительно есть уникальные участки хромосом, расположенные рядом с oriC ( начало репликации хромосомной ДНК ), и эти области вместе называются «окружением oriC».
Как уже отмечалось, некоторые ORF для S. haemolyticus отличаются от S. aureus и S. epidermidis . Некоторые из этих ORF кодируют генные продукты с известными биологическими особенностями, такими как регуляция синтеза РНК , транспорт рибозы и рибита , а также основные компоненты биосинтеза нуклеиновой кислоты и тейхоевой кислоты клеточной стенки . Другие уникальные ORF, вероятно, кодируют продукты, участвующие в бактериальном патогенезе, и по крайней мере три из этих ORF проявляют гомологию со стафилококковыми гемолизинами .
Haemolyticus С. геном , также содержит множество последовательностей вставки (ISS). Эти элементы IS могут способствовать частым перестройкам генома, которые ускоряют диверсификацию видов. Теоретически эти адаптации могут помочь S. haemolyticus преодолеть неблагоприятные последствия химического воздействия (например, использования антибиотиков ). В таблице ниже содержится список генов, которые, как известно, связаны с устойчивостью к антибиотикам S. haemolyticus .
Клеточная стенка
Как и другие грамположительные микробы, S. haemolyticus имеет толстую, довольно однородную клеточную стенку (60-80 нм), состоящую из пептидогликана , тейхоевой кислоты и белка . Пептидогликан группы A3 (с L-лизином в качестве диаминокислоты в положении 3 пептидной субъединицы и богатым глицином межпептидным мостиком) является характерной чертой этого микроба, и двумя преобладающими поперечными мостиками являются COOH-Gly-Gly- Ser-Gly-Gly-Nh3 и COOH-Ala-Gly-Ser-Gly-Gly-Nh3. Изменения этих поперечных мостиков участвуют в устойчивости к гликопептидам. Кислоты S. haemolyticus teichoic представляют собой водорастворимые полимеры с повторяющимися фосфодиэфирными группами, ковалентно связанными с пептидогликаном. Пептидогликан типа L-Lys-Gly 3,5-4,0, L-Ser0,9-1,5 Тейхоевая кислота содержит как глицерин, так и N-ацетилглюкозамин . Основными жирными кислотами клеточной стенки являются CBr-15, CBr-17, C18 и C20.
Капсула
Некоторые штаммы S. haemolyticus способны продуцировать капсульный полисахарид (CP). Штамм S. haemolyticus JCSC1435 содержит капсульный оперон, расположенный в «oriC Environment». Этот оперон содержит 13 ORF в области 14 652 п.н. и называется локусом cap sh . Первые семь генов из колпачка ш ( сар SH через ЦАПГ ш ) являются гомологичными к стафилококка S. CAP5 или cap8 локуса. Однако от capH до capM уникальны для S. haemolyticus , и эта область кодирует ферменты для уникального тридезоксисахарного остатка, который N-ацилируется аспарагиновой кислотой .
Производство CP зависит от питательной среды и фазы роста . Культивирование в триптическом соевом бульоне (TSB)], TSB с 1% глюкозы , бульоне для инфузии мозга и сердца или бульоне Columbia с 2% NaCl способствует производству CP; культивирование на чашках с колумбийским соляным агаром неоптимально. Только следовые количества CP генерируются до конца экспоненциальной фазы, и максимальная скорость производства CP не происходит до ранней стационарной фазы.
CP считается фактором вирулентности, поскольку он обеспечивает устойчивость к опосредованному комплементом полиморфноядерному фагоцитозу нейтрофилов .
Образование биопленки
Способность прикрепляться к медицинским устройствам и впоследствии образовывать биопленки является основным фактором вирулентности, связанным с S. haemolyticus . Образование биопленок увеличивает устойчивость к антибиотикам и часто приводит к хроническим инфекциям. Биопленки S. haemolyticus не зависят от полисахаридного межклеточного адгезина (PIA), и отсутствие оперона ica ( кластера генов , кодирующего продукцию PIA) можно использовать для отличия изолятов S. haemolyticus от других видов CoNS.
На формирование биопленок влияет множество факторов, включая углеводы , белки и внеклеточную ДНК . Анализы отслоения с NaIO 4 , протеиназой К или ДНКазой приводят к 38%, 98% и 100% отсоединению соответственно. Высокий уровень отслоения, связанный с обработкой ДНКазой, побудил некоторых авторов предположить функцию адгезии межклеточной ДНК и / или межклеточной адгезии для внеклеточной ДНК. На формирование биопленок также влияет присутствие глюкозы и NaCl. Образование биопленок усиливается при культивировании в TSB с 1% глюкозы и снижается при культивировании в TSB с 3% NaCl. Производство капсульного полисахарида снижает образование биопленок.
Субингибирующие концентрации (субминимальные ингибирующие концентрации ) антибиотика диклоксациллина также влияют на рост биопленок S. haemolyticus . Биопленки, образующиеся в присутствии субингибиторных концентраций диклоксациллина, содержат меньше биомассы и имеют измененный состав. Они тоньше, покрывают меньшую площадь поверхности и менее гидрофобны , но также обладают повышенным уровнем устойчивости к диклоксациллину.
Токсины
Некоторые штаммы S. haemolyticus продуцируют энтеротоксины (SE) и / или гемолизины . При исследовании 64 штаммов S. haemolyticus была отмечена продукция SEA, SEB, SEC и / или SEE (отсутствовал только SED). Кроме того, было обнаружено, что 31,3% штаммов продуцируют по крайней мере один тип энтеротоксина .
Идентификация
S. haemolyticus можно идентифицировать на уровне вида с помощью множества ручных и автоматизированных методов. Чаще всего используются: эталонный метод (на основе тестов роста), API ID 32 Staph (bioMe´rieux), Staph-Zym (Rosco), UZA (быстрый 4-часовой метод), а также полимеразная цепная реакция и электрофоретический анализ. из 16S рРНК , hsp60 , или сода последовательности гена . Предпочтение определенного метода обычно зависит от удобства, экономики и требуемой специфичности (некоторые виды имеют идентичную 16S рРНК). Наиболее близким видом S. haemolyticus является Staphylococcus borealis .
| Методика | Проведенные тесты | Интерпретация |
|---|---|---|
| Справка | 16 стандартных тестов роста, включая: пигмент колоний, ДНКазу, щелочную фосфатазу, орнитиндекарбоксилазу, уреазу, продукцию ацетоина, чувствительность к новобиоцину, устойчивость к полимиксину и выработку кислоты из D-трегалозы, D-маннита, D-маннозы, D-туранозы, D- ксилоза, D-целлобиоза, мальтоза и сахароза | Результаты сравниваются с литературой по видам стафилококков. |
| API ID 32 Staph (bioMe´rieux) | Бактериальная суспензия добавляется в набор лунок, содержащих высушенные субстраты для 26 колориметрических тестов. | После 24 часов инкубации при 37 ° C и добавления нескольких других реагентов результаты определяются на автоматизированном компьютере с использованием программного обеспечения APILAB ID 32. |
| Стаф-Зим (Роско) | Бактериальная суспензия добавляется в мини-пробирки для проведения 10 метаболических или ферментативных тестов. | Результаты определяются изменением цвета после 24 часов инкубации и тестами на чувствительность к полимиксину и новобиоцину. |
| УЗА (быстрый 4-часовой метод) | Этот метод состоит из двух этапов. Первый этап состоит из трех тестов, измеренных после четырехчасовой инкубации при 37 ° C: образование кислоты из D-трегалозы, уреазы и щелочной фосфатазы. Второй этап включает четыре возможных теста, которые проводятся по мере необходимости после 24 часов инкубации при 37 ° C. К ним относятся: орнитиндекарбоксилаза, чувствительность к новобиоцину, чувствительность к фосфомицину и анаэробный рост. | Результаты сравниваются с литературой по видам стафилококков. |
| ПЦР и электрофорез | Использует специфичные для гена вырожденные праймеры для амплификации фрагментов ДНК, эти фрагменты разделяются с помощью электрофореза, а затем очищаются для секвенирования ДНК. | Результаты определяются анализом последовательности. |
Клиническое значение
S. haemolyticus является вторым наиболее клинически изолированным CoNS ( S. epidermidis — первым) и считается важным внутрибольничным патогеном. Инфекции человека включают: эндокардит нативного клапана , сепсис , перитонит и инфекции мочевыводящих путей , ран , костей и суставов . Редкие инфекции мягких тканей обычно возникают у пациентов с ослабленным иммунитетом . Как и другие CoNS, S. haemolyticus часто связан с введением инородных тел , таких как протезные клапаны, шунты спинномозговой жидкости , ортопедические протезы , внутрисосудистые, мочевые и диализные катетеры . S. haemolyticus обладает множественной лекарственной устойчивостью и способен образовывать биопленки, что затрудняет лечение инфекций.
Инфекции, связанные с сосудистым катетером
Стафилококк на катетереS. haemolyticus может колонизировать центральные венозные катетеры и вызывать серьезные медицинские осложнения. Колонизация происходит, когда S. haemolyticus мигрирует из кожи, вдоль внешней поверхности устройства или из концентратора из-за манипуляций со стороны медицинских работников. В любом случае существует высокая вероятность того, что микроб сформирует биопленку. Эти инфекции могут оставаться локализованными или стать системными (например, бактериемия). Тяжести инфекции варьирует в зависимости от типа катетера , частоты манипуляции, а также факторов вирулентности от haemolyticus S. штамма. Удаление катетера обычно считается лучшим лечением, но это не всегда возможно. В качестве альтернативы можно вводить ванкомицин или тейкопланин . Недавние данные свидетельствуют о том, что гликопептиды можно дополнять бета-лактамами для синергетического действия.
Устойчивость к антибиотикам
S. haemolyticus имеет самый высокий уровень устойчивости к антибиотикам среди CoNS. Различные штаммы устойчивы к одному или нескольким из этих антибиотиков : пенициллинам , цефалоспоринам , макролидам , хинолонам , тетрациклинам , аминогликозидам , гликопептидам и фосфомицину (см. Серадски, Кшиштоф; Виллари, Паоло; Томаш, Александр (1998). «Снижение восприимчивости к тейкопланину и ванкомицину среди коагулазо-отрицательных метициллин-устойчивых клинических изолятов стафилококков» . Противомикробные препараты и химиотерапия . 42 (1): 100–107. DOI : 10.1128 / AAC.42.1.100 . PMC 105463 . PMID 9449268 .
Внешние ссылки
Стафилококкозы собак — Ветеринария и жизнь
Большое количество возбудителей в окружающей среде значительно усложняют жизнь домашних животных, в частности собаководов. Оградить животное от всех патогенов невозможно.
Поэтому, необходимо знать, как проявляются признаки заражения теми или иными микроорганизмами, в частности, патогенными стафилококками, и как лечить отдельно взятую инфекцию. Особенно распространены среди собак стафилококкозы.
Стафилококкозы — это группа заболеваний, причиной которых являются патогенные стафилококки видов: Staphylococcus aureus, Staphylococcus haemolyticus, Staphylococcus intermedius, Staphylococcus pseudintermedius, Staphylococcus epidermidis. Патология может развиваться по двум основным путям. Первый заключается в том, что стафилококк самостоятельно вызывает заболевание. В том случае, если он присоединяется к уже существующей проблеме, речь ведут о вторичной форме. Таким образом, стафилококк у собак может поражать различные органы (кожу, глаза, уши, слизистые оболочки носовой и ротовой полостей, мочеполовую систему, кровь и др.), но благодаря тому, что имеются характерные симптомы, можно вовремя заметить заболевание и начать лечение.
Стафилококк относится к грамположительным микроорганизмам. Он имеет шаровидную форму и определяется в виде скоплений, напоминающих гроздь винограда. Название бактерий возникло от лат. Staphylococcus, от греч. σταφυλή — «гроздь винограда» и греч. κόκκος — «зерно, ягода».
У каждой собаки имеется своя предрасположенность к возбудителю или же напротив, устойчивость.
При высокой сопротивляемости организма для инфицирования необходима огромная доза заражения.
В то же время, следует выделить основные предрасполагающие факторы, способствующие заболеванию:
— высокий уровень углеводов в организме собак;
— нарушение иммунитета;
— авитаминозы, а точнее недостаток витаминов A, E, группы В;
— отравление организма;
— заболевания кожи, в частности, клещи,блохи, аллергические реакции и пр.;
— настроенность иммунной системы в виде отсутствия устойчивости именно к этому возбудителю.
Практически все симптомы, которые вызывает стафилококк, связаны с состоянием кожи. Возможно, это объясняется тем, что у животного кожа не способна выполнять защитную функцию также эффективно, как, например, кожа человека. Наиболее часто регистрируется пиодермия, вызвать которую могут: золотистый стафилококк, гемолитический, псевдоинтермедиус и интермедиус, иногда эпидермальный стафилококк. Данная патология классифицируется в зависимости от того, на какую глубину распространяется патологический процесс. Поверхностная форма выражается в виде появления неглубоких эрозий и не сильно выраженного зуда. Прикосновение к ним вызывает болевые ощущения. Данная форма может быть с появлением влажных эрозий. Их провоцирует травма кожи или постоянное расчесывание вследствие наличия паразитов на коже собаки. Наиболее часто при этом золотистый стафилококк выявляется в области хвоста, на шее, под грудью и на лапах, в тех местах, где кожа наиболее тонкая и, следовательно, более уязвимая. Обострение заболевания может быть летом или весной, то есть в теплое время года.
Кроме этого пиодермия с поверхностным поражением кожи может регистрироваться у собак с выраженными кожными складками. В процессе жизнедеятельности в них скапливаются различные выделения и остатки корма. При отсутствии проветривания присоединяется инфекция, которой, как правило, и являются патогенные виды стафилококков.
Помимо кожного покрова, у собак стафилококк может поражать и слизистые оболочки ротовой полости, глаз, репродуктивных органов; уши.
Есть еще один симптом, который часто регистрируется у собак и не всегда владельцы догадываются, что его причиной также является стафилококк. Речь идет об отитах. Это может быть скрытое течение или бурно протекающая болезнь. В некоторых случаях патология поражает даже ткани внутреннего уха, что проявляется в виде язв и эрозий. Если данную патологию вовремя не вылечить, то может присоединиться конъюнктивит и ринит.
Чтобы распознать у собаки стафилококкоз, необходимо как можно раньше обратиться к врачу при появлении первых симптомов.
Основой диагностики стафилококкоза является бактериологический анализ. В качестве патологического материала в лабораторию направляют: пробы гноя, мокроты, смывы из носа, рта, дёсен, ушей и конъюнктивы, кровь, испражнения, пунктат из уха, соскобы с кожи, материалом для бактериологического исследования могут также служить пробы корма.
Специалисты ФГБУ «Краснодарская МВЛ» проводят диагностику стафилококкозов собак при помощи классических бактериологических методов, а также импортных тест-систем. Срок исследования составляет 4-5 дней.
Своевременно поставленный диагноз позволит грамотно провести лечение с учётом чувствительности выделенной культуры стафилококка к антибактериальным препаратам, получить лечебный эффект.
Источник: пресс-служба ФГБУ «Краснодарская МВЛ»
Подпишитесь на нас в ЯНДЕКС.НОВОСТИ и в Telegram , чтобы читать новости сразу, как только они появляются на сайте.
Staphylococcus haemolyticus как важный госпитальный патоген и носитель генов устойчивости к метициллину
Abstract
Фенотипические и молекулярные методы были использованы для характеристики устойчивости к антибиотикам 64 клинических изолятов Staphylococcus haemolyticus . С помощью ПЦР гена mecA 87% оказались устойчивыми к метициллину. Приблизительно 55% содержали стафилококковый кассетный элемент хромосомы mec (SCC mec ) типа V и только один SCC mec типа IV.Многие изоляты (75%) продемонстрировали множественную резистентность, а анализ пульсотипа показал высокое разнообразие.
ТЕКСТ
Среди коагулазонегативных стафилококков (CoNS), Staphylococcus haemolyticus является вторым по частоте выделения из культур крови человека (18) и имеет самый высокий уровень устойчивости к противомикробным препаратам (3, 8). Устойчивость к метициллину обеспечивается геном mecA , переносимым стафилококковым кассетным элементом хромосомы mec (SCC mec ) (12).Восемь типов (от I до VIII) SCC mec были отнесены к Staphylococcus aureus (11), а SCC mec типа V уже обнаружен в CoNS, в частности, у S. haemolyticus (13). Увеличение частоты устойчивых к метициллину S. haemolyticus как возбудителя госпитальных инфекций и возможность возникновения устойчивости к другим антибиотикам требует достоверной характеристики изолятов и исследования распространения клонов в больницах.
В исследованиях, представленных здесь, в период с 2006 по 2008 год 64 клинических штамма были выделены от пациентов военно-морского госпиталя Марсилио Диас, Рио-де-Жанейро, Бразилия. Штаммы были выделены из следующих клинических инфекций или источников у 31 мужчины и 33 женщин: бактериемия ( n = 45), кожа ( n = 2), моча ( n = 13) и неизвестный источник ( n = 4). Изоляты были идентифицированы в больничной лаборатории как S. haemolyticus с помощью панели MicroScan WalkAway PC21, и их идентификация была подтверждена специфической ПЦР (17).
Профили устойчивости штаммов к основным антибиотикам, используемым в Бразилии, были определены с помощью диско-диффузионных тестов в соответствии с рекомендациями CLSI (5). Однако тест на чувствительность к мупироцину не был предварительно согласован CLSI, поэтому результаты для этого антибиотика были интерпретированы, как описано ранее (7, 9). Устойчивость к метициллину также оценивали другими фенотипическими методами, такими как MIC для оксациллина (5), MicroScan и ПЦР гена mecA (6). Тип SCC mec был определен в мультиплексной ПЦР, как описано ранее (14), за исключением того, что пара праймеров mecI P2 и mecI P3, использованная в качестве внутреннего контроля, была заменена на MRS1 и MRS2 (6), которые амплифицируют 154- Фрагмент п.н. гена mecA .
Анализ генетического родства и характеристики изолятов с использованием гель-электрофореза в импульсном поле (PFGE) геномной ДНК, расщепленной с помощью SmaI, проводили, как описано ранее (20). Образцы полос определялись визуальным осмотром и с использованием программного обеспечения Bionumerics, версия 6.0 (прикладная математика), с использованием индекса Dice и метода невзвешенных пар со средним арифметическим. Сходные генотипы PFGE были определены с использованием коэффициента сходства до 80%, а подтипы были с вариантами менее чем с пятью диапазонами, как рекомендовано van Belkun et al.(19).
Как показано на, профили устойчивости к антибиотикам сильно различались. В этой коллекции штаммы были устойчивы по крайней мере к одному из протестированных антибиотиков, а чувствительность к ванкомицину наблюдалась у всех изолятов. Более того, 75% изолятов были мультирезистентными, проявляя устойчивость к более чем трем классам антибиотиков. Важно подчеркнуть, что 88% штаммов были классифицированы как устойчивые к метициллину согласно определению диско-диффузионного анализа цефокситина.Когда были выполнены другие тесты для оценки устойчивости к метициллину и с учетом определения гена mecA как окончательного, было получено семь противоречивых результатов. Один результат был ложноотрицательным для всех фенотипических методов и только один для MicroScan. Фактически, обнаружение гена mecA с помощью ПЦР не позволяет дать функциональную характеристику этого гена. Например, некоторые генетические мутации могут препятствовать производству активных белков. Также наблюдались ложноположительные результаты.Пять изолятов с отрицательными результатами для гена mecA показали противоречивые результаты с фенотипическими методами. Три из них были классифицированы как устойчивые только с помощью MicroScan, один — по дисковой диффузии и один — по всем фенотипическим тестам.
Таблица 1
Паттерны антибиотиков 64 штаммов S. haemolyticus , определенные с помощью диско-диффузионного теста
| Противомикробный агент | Количество (%) изолятов S. haemolyticus , которые были: | ||
|---|---|---|---|
| Восприимчивый | Промежуточный | Устойчивый | |
| Пенициллин | 3 (5) | 0 | 61 (95) |
| Ампициллин | 3 (5) | 0 | 61 (95 ) |
| Оксациллин | 8 (12) | 0 | 56 (88) |
| Цефокситин | 8 (12) | 0 | 56 (88) |
| Гентамицин | 16 ( 25) | 1 (2) | 47 (73) |
| Ципрофлоксацин | 18 (28) | 0 | 46 (72) |
| Эритромицин | 21 (33) | 2 (3) | 41 (64) |
| Триметоприм-сульфаметоксазол | 27 (42) | 3 (5) | 34 (53) |
| Клиндамицин | 34 ( 53) | 0 | 30 (47) |
| Хлорамфеникол | 48 (75) | 0 | 16 (25) |
| Тетрациклин | 50 (78) | 2 (3) | 12 (19) |
| Рифампицин | 54 (84) | 3 (5) | 7 (11) |
| Мупироцин | 58 (90) | 1 (2) | 5 (8) |
Среди 56 mecA -положительных штаммов только 32 (57%) могут быть отнесены к известным типам SCC mec .Тридцать один изолят (55%) имел SCC mec тип V и только один имел SCC mec тип IV. Элементы SCC mec распространены среди изолятов S. haemolyticus , и эти микроорганизмы считаются потенциальными донорами SCC mec . Данные свидетельствуют о горизонтальном переносе SCC mec типа V от метициллин-резистентного S. haemolyticus к метициллин-чувствительному S. aureus , что привело к созданию нового метициллин-устойчивого S.aureus (MRSA), который может вызвать потенциальную вспышку (1). Остальные 24 штамма (43%) не поддаются типированию с помощью используемого метода, что можно объяснить наличием новых структур или перегруппировок и рекомбинацией SCC mec (4, 22). Появление новых вариантов элемента SCC mec , обнаруженное в этом исследовании, и возможность переноса гена будут дополнительно изучены и охарактеризованы.
На основе кластеризации PFGE () 64 изолята были типизированы в 51 профиль PFGE (PFP).Только две пары изолятов (штаммы 54 и 57 и штаммы 60 и 63) показали идентичные PFP. Не было единственного клона с фиксированным пульсотипом, распространенного среди этих пациентов, хотя штаммы с разными PFP часто содержали один и тот же элемент SCC mec , тип V.
Дендрограмма компьютерного анализа профилей PFGE, полученных для 64 S. haemolyticus .
S. haemolyticus широко распространен в больницах и имеет тенденцию к развитию устойчивости к нескольким антибиотикам (15, 21).Это наблюдалось в этом исследовании, и самые высокие показатели устойчивости были обнаружены для β-лактамов. Существует несколько методов определения устойчивости к метициллину, и некоторые из них были использованы здесь. Как и в других исследованиях, были обнаружены ложноположительные и ложноотрицательные результаты. Фактически, недавно был описан новый гомолог mecA в S. aureus , который был фенотипически устойчивым к метициллину, но дал отрицательный результат на ген mecA . Этот ген был локализован в новом SSC mec , обозначенном как тип XI (10).Устойчивость к оксациллину без гена mecA может быть вызвана либо избыточной продукцией, либо сверхэкспрессией пенициллиназы, либо изменением других связывающих пенициллин белков (2). Что касается типирования SCC mec , результаты сопоставимы с распределением типов SCC mec среди штаммов S. haemolyticus , которые оказались основными резервуарами типа V (13, 16). Кроме того, большое генетическое разнообразие среди образцов, в том числе устойчивых к метициллину, подчеркивает возможность горизонтального распространения SCC mec среди S.haemolyticus штаммов. Чрезвычайная пластичность генома S. haemolyticus была сделана путем полного секвенирования генома штамма JCSC1435, который идентифицировал до 82 инсерционных последовательностей в его хромосоме. Эта характеристика может привести к частым перестройкам генома, фенотипической диверсификации и приобретению устойчивости к антибиотикам. Это показало, как важные с медицинской точки зрения виды стафилококков диверсифицируются, чтобы успешно колонизировать или инфицировать человека-хозяина (18).
В заключение, наши тесты показали высокую распространенность полирезистентности среди изолятов S. haemolyticus . Фенотипические тесты хорошо коррелировали с генотипической характеристикой устойчивости к метициллину, но наблюдались некоторые противоречивые результаты. SCC mec типа V был наиболее распространенным, хотя многие штаммы не были типируемыми. Несмотря на большое генетическое разнообразие, S. haemolyticus играет важную роль в качестве эффективного реципиента и / или носителя элементов SCC mec .
Staphylococcus haemolyticus — microbewiki
Страница Microbial Biorealm по роду Staphylococcus haemolyticus
Классификация
Таксоны высшего порядка
Бактерии; Фирмикуты; Бациллы; Бациллы; Staphylococcaceae; Стафилококк
Виды
Staphylococcus haemolyticus
Описание и значение
Staphylococus haemolyticus — коагулазонегативный представитель рода Staphylococcus.Бактерии могут быть обнаружены на нормальной флоре кожи человека и могут быть выделены из подмышечных впадин, промежности и паховых областей человека. S.haemolyticus также является вторым по частоте встречаемости коагулазонегативных стафилококков в крови человека (1).
Не обладая коагулазой, ферментоподобным белком, который традиционно ассоциировался с вирулентным потенциалом стафилококков, коагулазонегативные стафилококки обычно считаются низковирулентными патогенами по сравнению с хорошо известным патогенным коагулазо-положительным Staphylococcus aureus .Однако недавние исследования показывают, что коагулазонегативные стафилококки стали основной причиной оппортунистической инфекции (2). Staphylococcus haemolyticus сам по себе также является замечательным условно-патогенным микроорганизмом, который хорошо известен своим фенотипом с высокой устойчивостью к антибиотикам (3). Бактерии могут вызывать менингит, инфекции кожи или мягких тканей, инфекции протезных суставов или бактериемию (2). Способность бактерий одновременно противостоять нескольким типам антибиотиков наблюдалась и изучалась в течение длительного времени (2).Общие антибиотики, к которым у S. haemolyticus резистентность, включают метициллин, гентамицин, эритормицин и уникальные среди стафилококков гликопептидные антибиотики (2). Гены устойчивости к каждому типу антибиотика могут быть расположены на хромосоме (метициллин), на плазмидах (эритромицин) или на хромосоме и плазмидах (гентамицин) (4).
Чтобы изучить способность Staphylococcus haemolyticus к множественной лекарственной устойчивости и его патогенные признаки, исследователи секвенировали весь геном одного штамма, JCSC1435 (3).Помимо генов устойчивости бактерий к антибиотикам, исследование последовательности также выявило удивительное количество гомологичных инсерционных последовательностей (IS), которые могут быть ответственны за частые геномные структуры, наблюдаемые в этом организме (4).
Структура генома
Геном Staphylococcus haemolyticus (штамм JCSC1435) включает кольцевую хромосому размером 2 685 015 пар оснований и 3 плазмиды размером 2300 пар оснований, 2366 пар оснований и 8 180 пар оснований (3).
Сравнительный геномный анализ выявил значительное сходство между геномами S.haemolyticus и два других хорошо известных стафилококка, S. aureus и S. epidermis . Помимо сопоставимых размеров генома, большая часть открытых рамок считывания (orfs) сохраняется как в последовательностях, так и в их порядке на хромосоме (3). Однако исследование также обнаружило область на хромосоме, уникальную для каждого из трех организмов. Эта область, расположенная рядом с ориджином репликации хромосомы (oriC), поэтому называется «oriC Environment». Поскольку большая часть области может быть удалена, не влияя на рост, можно сделать вывод, что область oriC Environment не содержит генов, необходимых для жизнеспособности бактерий (3).С другой стороны, этот регион, скорее всего, отвечает за разнообразие видов стафилококков и позволяет бактериям успешно колонизировать и инфицировать человека-хозяина (3).
Помимо наличия области oriC Environment, в которой часто могут происходить перестройки генома, S.haemolyticus также обладает удивительно большим количеством инсерционных последовательностей (IS) (3). Эти IS могут либо инактивировать ген путем прямой интеграции в открытую рамку считывания, либо активировать ген, снабдив ген мощным промотором.Изменяя состав генома, элементы IS могут способствовать врожденной способности бактерий приобретать лекарственную устойчивость (3).
В то время как 6% orfs, обнаруженных в более вирулентном S.aureus , являются патогенными факторами, только 2% из тех, что обнаружены в S.haemolyticus , являются патогенными факторами (3). Однако именно способность S.haemolyticus изменять свой геном и приобретать устойчивость к антибиотикам делает этот вид замечательным и трудно контролируемым условно-патогенным микроорганизмом.
Строение клетки и обмен веществ
Стенка клетки
Как грамположительный вид, как и другие стафилококки, S.haemolyticus имеет толстую пептидогликановую стенку за пределами своей мембраны и, следовательно, может быть мишенью антибиотиков, которые мешают процессу биосинтеза пептидогликана. Однако у некоторых штаммов S.haemolyticus развилась устойчивость к гликопептидным антибиотикам, таким как тейкопланин и ванкомицин (5, 13). Это уникальная способность стафилококков (5).Структура пептидогликана S.haemolyticus была изучена (5), чтобы выяснить факторы, ответственные за эту особую устойчивость.
Как и у других стафилококков, пептидогликан S.haemolyticus сильно сшит. Преобладающими поперечными мостиками являются COOH-Gly-Gly-Ser-Gly-Gly-Nh3 и COOH-Ala-Gly-Ser-Gly-Gly-Nh3. В устойчивых штаммах исследования обнаружили поперечные мостики, которые содержат дополнительный серин вместо глицина (таким образом, поперечными мостиковыми структурами являются COOH-Gly-Ser-Ser-Gly-Gly-Nh3 и COOH-Ala-Gly-Ser-Ser- Gly-Nh3) (5).Кроме того, присутствие нового цитоплазматического предшественника пептидогликана, UDP-мурамил-тетрапептида-D-лактата, было обнаружено в штаммах S.haemolyticus (5). Этот предшественник и изменения поперечных мостиков, как полагают, мешают совместному связыванию гликопептидных антибиотиков, таких как ванкомицин и тейкопланин, с их мишенями в S.haemolyticus (5).
Метаболизм
Полногеномное секвенирование S.haemolyticus (штамм JCSC1435) выявило некоторые orfs, кодирующие метаболические гены, уникальные для данного вида, такие как гены, участвующие в транспорте рибозы и рибита или биосинтезе основных компонентов нуклеиновых кислот и техоевых кислот клеточной стенки ( 3).Благодаря этим уникальным орфам, S.haemolyticus обладает относительно высокой биосинтетической способностью. Штамму JCSC1435 требуется только аргинин для роста, тогда как штамму S.aureus N315 требуется доступность множества различных аминокислот: аланина, глицина, изолейцина, аргинина, валина и пролина (3).
S.haemolyticus (штамм JCSC1435) также обладает способностью ферментировать маннит, метаболическая характеристика, также обнаруженная у некоторых других «не золотистых» стафилококков (3).Однако генетический анализ показал, что определенные штаммы S.haemolyticus могли получить эту способность в результате горизонтального переноса генов локуса PTS маннитола от других видов бактерий (3). Это еще один пример, демонстрирующий гибкость генома S.haemolyticus .
Экология
Staphylococcus haemolyticus может быть обнаружен на коже и в организме многих млекопитающих, включая просимий, обезьян, домашних животных и человека (1).Наиболее частые естественные места обитания бактерий у человека находятся в подмышечных впадинах (подмышечная область), в промежности (лобковая область) и в паховой области (1). S.haemolyticus успешно выживает в более сухих частях тела (1), а также часто встречается в культурах крови человека (3).
Известно, что S.haemolyticus продуцирует ингибитор гонококкового роста, GGI (1). Впервые было обнаружено, что это вещество вызывает утечку цитоплазмы в гонококковых клетках и в конечном итоге приводит к их гибели (1,6).Примечательно, что это вещество также может лизировать эритроциты, особенно лошади и человека (6).
Патология
Стафилококки обычно вызывают заболевания из-за их способности широко распространяться в тканях и выработки внеклеточных веществ (7). Одним из примеров таких веществ является коагулаза, ферментоподобный белок, продуцируемый S.aureus , который может откладывать фибрин на поверхности бактерий, изменяя их поглощение и разрушение фагоцитарными клетками (7).
Традиционно считается, что продукция коагулазы представляет собой инвазивный патогенный потенциал среди стафилококков (7). S.haemolyticus , однако, является коагулазонегативным видом. Следовательно, как и у других стафилококков, не являющихся aureus, его патогенные признаки не были хорошо изучены до недавнего времени, когда S.haemolyticus стал основной причиной нозокомиальных инфекций (инфекции, приобретенные во время лечения в больнице по поводу другого заболевания). Зарегистрированы случаи заражения S.haemolyticus включают сепсис (дисфункцию систем органов в результате иммунного ответа на тяжелую инфекцию), перитонит (воспаление серозной оболочки, выстилающей брюшную полость) и инфекции мочевыводящих путей, ран, костей и суставов (1). Сообщалось также, что в редких случаях S.haemolyticus вызывает инфекционный эндокардит, воспаление сердца (эндокарда), что может привести к серьезным осложнениям, таким как сердечная недостаточность или смерть (2). Общие клинические симптомы S.haemolyticus — лихорадка и увеличение популяции лейкоцитов (лейкоцитоз) (2).
Являясь наиболее распространенным патогеном среди стафилококков, вирулентные факторы S.aureus хорошо известны. Среди них важны различные классы энтеротоксинов (токсины, выделяемые в нижних отделах кишечника, вызывающие пищевое отравление), токсины синдрома токсического шока и гемолизин (вещества, которые позволяют бактериям разрушать эритроциты) (8). Некоторые из этих веществ считались принадлежащими исключительно к группе S.aureus , но недавно были обнаружены и у других коагулазонегативных стафилококков, не относящихся к aureus (1). Например, в одном исследовании, опубликованном в 1994 г., все исследуемые штаммы S.haemolyticus продуцировали гемолизины in vitro (9). Поэтому исследователи предположили, что гемолизины могут быть важным фактором, ответственным за высокую вирулентность этого вида стафилококков (9).
S.haemolyticus ’GGI родственны по функции и характеристикам другим относительным вирулентным факторам стафилококков, таким как дельта-лизин в S.aureus и SLUSH (синергический гемолизин Staphylococcus lugdunensis ) в S.lugdunensis , последний из которых показывает значительное сходство по структуре с GGI (1). Эти данные свидетельствуют о связи между путями патогенеза и вирулентными факторами распространенных стафилококковых патогенов.
Применение в биотехнологии
Staphylococcus haemolyticus вместе с родственными ему стафилококками, такими как S.aureus и S.epidermis , обладает классом липазных ферментов, которые участвуют в процессе гидролиза длинноцепочечных триацилглицеронов (10). Благодаря уникальным полезным свойствам ферментов, таким как избирательность по длине цепи и хиральная селективность, они широко используются в промышленном производстве и синтезе жирных кислот, жиров, масел, сложных эфиров и пептидов (10).
Близкий родственник S.haemolyticus , коагулазонегативный Staphylococcus xylosus , был использован для создания системы вектор-хозяин, которая может экспрессировать рекомбинантные белки на поверхности бактериальной клетки (11).Впервые такая система могла быть построена на грамположительных видах. Этот метод значительно облегчает изучение рецепторов, субстрат-связывающих белков и других антигенных детерминант, экспрессируемых на поверхности бактерий (11).
Текущие исследования
Хотя Staphylococcus haemolyticus относительно менее вирулентен, чем некоторые другие стафилококки, такие как S.aureus , способность этого вида приобретать множественную антибиотикорезистентность представляет серьезную угрозу для медицинских учреждений во всем мире.Полногеномное секвенирование S.haemolyticus , проведенное исследовательской группой из Университета Джутендо в Токио, Япония, под руководством доктора Кейити Хирамацу (3), является очень важным и значительным шагом в решении этой проблемы. Информация, предоставляемая последовательностью генома, не только позволит провести дальнейшие исследования характерного для данного вида бактериального образа жизни, но также будет способствовать «разработке новых иммунотерапевтических и химиотерапевтических подходов для их контроля» (3).
После обнаружения большого количества копий IS в хромосоме, как упоминалось выше (3), Dr.Группа Хирамацу продолжает изучать другие типы генетической перестройки, которые также ответственны за частые структурные изменения генома S.haemolyticus . Недавние результаты пролили свет на новый механизм генетической перетасовки S.haemolyticus , в котором «точное удаление и самоинтеграция составного транспозона» (ISSha1) приводит к крупномасштабной инверсии / делеции хромосом, обнаруженной в клиническом штамме. JCSC1435 (12).
Помимо геномных и генетических подходов, проводятся клинические исследования в сочетании с молекулярными подходами для поиска более эффективных стратегий против развития S.haemolyticus устойчивые к антибиотикам штаммы. Исследования нацелены на многообещающую стратегию, в которой различные типы антибиотиков используются синергетически для борьбы с конкретными устойчивыми к антибиотикам штаммами. Некоторыми примерами являются комбинация гликопептидных и бета-лактамных антибиотиков против метициллин- и тейкопланин-резистентных штаммов стафилококков или комбинация ванкомицина и бета-лактамных антибиотиков (13).
Список литературы
1. Тристан, А., Лина, Г., Этьен, Дж.И Ванденеш Ф. в (редакторы Фишетти В., Новик Р., Ферретти Дж., Портной Д. и Руд Дж.) 572-586 (ASM Press, Вашингтон, округ Колумбия, 2006).
2. Falcone, M. et al. Эндокардит, вызванный Staphylococcus haemolyticus: клинико-микробиологический анализ 4 случаев. Диаг. Microbiol. Заразить. Дис. 57, 325-331 (2007).
3. Takeuchi, F. et al. Полногеномное секвенирование staphylococcus haemolyticus раскрывает крайнюю пластичность его генома и эволюцию видов стафилококков, колонизирующих человека.J. Bacteriol. 187, 7292-7308 (2005).
4. Фроггатт, Дж. У., Джонстон, Дж. Л., Галетто, Д. У. и Арчер, Г. Л. Устойчивость к противомикробным препаратам у внутрибольничных изолятов Staphylococcus haemolyticus. Противомикробный. Агенты Chemother. 33, 460-466 (1989).
5. Billot-Klein, D. et al. Синтез и структура пептидогликана в Staphylococcus haemolyticus, выражающем повышенные уровни устойчивости к гликопептидным антибиотикам. J. Bacteriol. 178, 4696-4703 (1996).
6. Уотсон, Д. К., Yaguchi, M., Bisaillon, J. G., Beaudet, R. & Morosoli, R. Аминокислотная последовательность ингибитора роста гонококков из Staphylococcus haemolyticus. Biochem. J. 252, 87-93 (1988).
7. Брукс, Г., Бутел, Дж. И Морс, С. в медицинской микробиологии 197-202 (McGraw-Hill, Нью-Йорк, 2001).
8. Новик, Р. в грамположительных патогенах (ред. Фишетти, В., Новик, Р., Ферретти, Дж., Портной, Д. и Руд, Дж.) 496-510 (ASM Press, Вашингтон, округ Колумбия) , 2006).
9. Мольнар, К., Hevessy, Z., Rozgonyi, F. & Gemmell, C.G. Патогенность и вирулентность коагулазонегативных стафилококков в отношении адгезии, гидрофобности и продукции токсинов in vitro. J. Clin. Патол. 47, 743-748 (1994).
10. О, Б., Ким, Х., Ли, Дж., Канг, С. и О, липаза T. Staphylococcus haemolyticus: биохимические свойства, субстратная специфичность и клонирование гена. FEMS Microbiol. Lett. 179, 385-392 (1999).
11. Hansson, M. et al. Экспрессия рекомбинантных белков на поверхности коагулазонегативной бактерии Staphylococcus xylosus.J. Bacteriol. 174, 4239-4245 (1992).
12. Ватанабе, С., Ито, Т., Моримото, Ю., Такеучи, Ф., Хирамацу, К. Точное удаление и самоинтеграция составного транспозона как модель спонтанной крупномасштабной инверсии / делеции хромосом клинического штамма Staphylococcus haemolyticus JCSC1435. J. Bacteriol. 189, 2921-2925 (2007).
13. Виньяроли, К., Бьяваско, Ф. и Варальдо, П. Е. Взаимодействие между гликопептидами и бета-лактамами против изогенных пар чувствительных к тейкопланину и устойчивых штаммов Staphylococcus haemolyticus.Противомикробный. Агенты Chemother. 50, 2577-2582 (2006).
КМГ
Staphylococcus Haemolyticus — обзор
B грамположительные организмы
Фторхинолоны обладают хорошей активностью против Staphylococcus aureus и многих коагулазонегативных стафилококков (Barry, 1990; Eliopoulos and Eliopoulos, 1992). Сюда входят Staphylococcus epidermidis, Staphylococcus haemolyticus и мочевой патоген Staphylococcus saprophyticus .В 1980-х годах МПК фторхинолонов против стафилококков, включая устойчивые к метициллину стафилококки, варьировались от 0,25 до 2 мкг / мл. К сожалению, с 1989 г. метициллин-устойчивый S. aureus , устойчивый к фторхинолонам, был обнаружен в Соединенных Штатах и остальном мире (Blumberg et al. ., 1991; Kaatz et al. ., 1991; Isaacs et al. al ., 1989; Maple et al ., 1989; Schaeffer, 1989; Shalit et al ., 1989). Эти штаммы имеют МИК в диапазоне 4–32 мкг мкг / мл. Такие соединения, как тосуфлоксацин и спарфлоксацин, ингибируют стафилококки при более низких концентрациях (например, 0,12 мкг / мкг / мл) и будут ингибировать ряд устойчивых к метициллину S. aureus (MRSA), устойчивых к ципрофлоксацину в концентрациях 1 мкг . г / мл (Chin et al ., 1991).
Ряд фторхинолонов не обладают клинически эффективной активностью против стрептококков, таких как Streptococcus pyogenes , Streptococcus agalactiae и Streptococcus pneumoniae .Эноксацин, ломефлоксацин, пефлоксацин, амифлоксацин, норфлоксацин и флероксацин имеют МИК для этих видов в диапазоне 4–16 мк мкг / мл. Ципрофлоксацин, офлоксацин, темафлоксацин, тосуфлоксацин и спарфлоксацин подавляют виды стрептококков, причем наибольшая активность наблюдается со спарфлоксацином, тосуфлоксацином и некоторыми из перечисленных соединений, таких как OPC-17116 и PD-127391; соединения (Barry и др. ., 1992).
Активность фторхинолонов в отношении видов энтерококков также варьирует, хотя многие штаммы ингибируются 2 μ мкг / мл офлоксацина, ципрофлоксацина и темафлоксацина (Chin et al ., 1988). Тосуфлоксацин и спарфлоксацин более активны (Чин и др. ., 1991; Эспиноза и др. ., 1988). Listeria monocytogenes ингибируются новыми фторхинолонами, но не теми фторхинолонами, которые не подавляют виды стрептококков (Neu, 1992).
Сравнительное исследование липидомной адаптации, вызванной истощением питательных веществ, у Staphylococcus haemolyticus и Staphylococcus epidermidis
Zhang, Y. M. & Rock, C.O. Гомеостаз мембранных липидов у бактерий. Nat Rev Microbiol 6 , 222–233, https://doi.org/10.1038/nrmicro1839 (2008).
Артикул PubMed Google Scholar
Силиакус, М. Ф., ван дер Ост, Дж. И Кенген, С. В. М. Адаптация мембран архей и бактерий к изменениям температуры, pH и давления. Extremophiles 21 , 651–670, https://doi.org/10.1007/s00792-017-0939-x (2017).
CAS Статья PubMed Central PubMed Google Scholar
Krulwich, T. A. Щелочные прокариоты. Прокариоты: Справочник по биологии бактерий , Том 2 , Третье издание , 283–308, https://doi.org/10.1007/0-387-30742-7_10 (2006).
Хираока, С., Мацузаки, Х. и Сибуя, И. Активное увеличение синтеза кардиолипина в стационарной фазе роста и его физиологическое значение для Escherichia coli. FEBS Lett 336 , 221–224 (1993).
CAS Статья PubMed Google Scholar
Лопес, С. С., Алиса, А. Ф., Херас, Х., Ривас, Э. А. и Санчес-Ривас, К. Роль анионных фосфолипидов в адаптации Bacillus subtilis к высокой солености. Microbiology 152 , 605–616, https://doi.org/10.1099/mic.0.28345-0 (2006).
CAS Статья PubMed Google Scholar
Сейдлова Г. и Свободова Дж. Развитие мембранных липидов у продуцента сурфактина Bacillus subtilis. Folia Microbiol (Praha) 53 , 303–307, https://doi.org/10.1007/s12223-008-0047-5 (2008).
CAS Статья Google Scholar
Бари, П. С. Устойчивые к антибиотикам грамположительные кокки: значение для хирургической практики. World J Surg 22 , 118–126 (1998).
CAS Статья PubMed Google Scholar
Шаффер, Р. К. Проблема устойчивости к антибиотикам Staphylococcus : уроки больничных яслей в середине 20-го века. Йельский университет, биол. Медицина 86 , 261–270 (2013).
CAS PubMed Central PubMed Google Scholar
Kloos, W. E. и Musselwhite, M. S. Распространение и устойчивость Staphylococcus и Micrococcus разновидностей и других аэробных бактерий на коже человека. Appl Microbiol 30 , 381–385 (1975).
CAS PubMed Central PubMed Google Scholar
Дай Л. и др. . Staphylococcus epidermidis, извлеченный из постоянных катетеров, демонстрирует улучшенное диспергирование биопленок и «самообновление» за счет подавления агр. BMC Microbiol 12 , 102, https://doi.org/10.1186/1471-2180-12-102 (2012).
CAS Статья PubMed Central PubMed Google Scholar
Otto, M. Staphylococcus epidermidis — «случайный» возбудитель. Nat Rev Microbiol 7 , 555–567, https://doi.org/10.1038/nrmicro2182 (2009).
CAS Статья PubMed Central PubMed Google Scholar
де Аллори, М. К., Юре, М. А., Ромеро, К. и де Кастильо, М. Е. Устойчивость к противомикробным препаратам и образование биопленок в клинических изолятах коагулазонегативных штаммов Staphylococcus . Biol Pharm Bull 29 , 1592–1596 (2006).
Артикул PubMed Google Scholar
Fredheim, E.G. и др. . Образование биопленок Staphylococcus haemolyticus. J Clin Microbiol 47 , 1172–1180, https://doi.org/10.1128/JCM.01891-08 (2009).
CAS Статья PubMed Central PubMed Google Scholar
Nahaie, M. R., Goodfellow, M., Minnikin, D. E. & Hajek, V. Состав полярных липидов и изопреноидных хинонов в классификации Staphylococcus . J Gen Microbiol 130 , 2427–2437, https://doi.org/10.1099/00221287-130-9-2427 (1984).
CAS PubMed Google Scholar
Sohlenkamp, C. & Geiger, O. Липиды бактериальных мембран: разнообразие структур и путей. FEMS Microbiol Ред. (2015).
ден Камп, Дж. А., Редай, И. и ван Динен, Л. Л. Фосфолипидный состав Bacillus subtilis. J Bacteriol 99 , 298–303 (1969).
Google Scholar
Рой, Х. и Ибба, М. Широкий диапазон аминокислотной специфичности РНК-зависимого ремоделирования липидов под действием нескольких факторов устойчивости к пептидам. J Biol Chem 284 , 29677–29683 (2009).
CAS Статья PubMed Central PubMed Google Scholar
Slavetinsky, C.J., Peschel, A. & Ernst, C.M.Аланил-фосфатидилглицерин и лизил-фосфатидилглицерин транслоцируются одними и теми же флиппазами MprF и обладают сходной способностью защищать от антибиотика даптомицина в Staphylocureoccus . Антимикробные агенты Chemother 56 , 3492–3497 (2012).
CAS Статья PubMed Central PubMed Google Scholar
Пешель, А. и др. . Staphylococcus aureus Устойчивость к человеческим дефенсинам и уклонение от уничтожения нейтрофилов с помощью нового фактора вирулентности MprF основана на модификации мембранных липидов L-лизином. J Exp Med 193 , 1067–1076 (2001).
CAS Статья PubMed Central PubMed Google Scholar
Хебеккер, С. и др. . Структуры двух факторов устойчивости бактерий, опосредующих тРНК-зависимое аминоацилирование фосфатидилглицерина лизином или аланином. Proc Natl Acad Sci USA 112 , 10691–10696 (2015).
ADS CAS Статья PubMed Central PubMed Google Scholar
Атила М. и Луо Ю. Профилирование и тандемный масс-спектрометрический анализ аминоацилированных фосфолипидов в Bacillus subtilis. F1000Res 5 , 121, https://doi.org/10.12688/f1000research.7842.2 (2016).
Артикул PubMed Central PubMed Google Scholar
Атила М., Кацелис Г., Чумала П. и Луо Ю. Характеристика N-сукцинилирования L-лизилфосфатидилглицерина в Bacillus subtilis с использованием тандемной масс-спектрометрии. J Am Soc Mass Spectrom 27 , 1606–1613, https://doi.org/10.1007/s13361-016-1455-4 (2016).
CAS Статья PubMed Google Scholar
Кронан, Дж. Э. младший, Вайсберг, Л. Дж. И Аллен, Р. Г. Регулирование синтеза липидов мембран в Escherichia coli.Накопление свободных жирных кислот аномальной длины во время ингибирования синтеза фосфолипидов. J Biol Chem 250 , 5835–5840 (1975).
CAS PubMed Google Scholar
Миндич, Л. Контроль синтеза жирных кислот у бактерий. J Bacteriol 110 , 96–102 (1972).
CAS PubMed Central PubMed Google Scholar
Блай, Э. Г. и Дайер, У. Дж. Быстрый метод экстракции и очистки общих липидов. Can J Biochem Phys 37 , 911–917 (1959).
CAS Статья Google Scholar
Луо, Ю. Праймер аланилированной липотейхоевой кислоты в Bacillus subtilis. F1000Res 5 , 155 (2016).
Артикул PubMed Central PubMed Google Scholar
Лейкер, Т. Дж., Баркли, Р. М. и Мерфи, Р. С. Анализ молекулярных видов диацилглицерина в экстрактах клеточных липидов с помощью масс-спектрометрии с электрораспылением с жидкостной хроматографией в нормальной фазе. Int J Mass Spectrom 305 , 103–109, https://doi.org/10.1016/j.ijms.2010.09.008 (2011).
CAS Статья PubMed Central PubMed Google Scholar
Мерфи Р. и Аксельсен П. Х. Масс-спектрометрический анализ длинноцепочечных липидов. Mass Spectrom Rev 30 , 579–599, https://doi.org/10.1002/mas.20284 (2011).
ADS CAS Статья PubMed Google Scholar
Coulon, D. & Bure, C. Ацилфосфатидилглицерин (ацил-PG) или N-ацилфосфатидилэтаноламин (NAPE)? J Масс-спектр 50 , 1318–1320, https://doi.org/10.1002/jms.3701 (2015).
ADS CAS Статья PubMed Google Scholar
Печ-Канул, А. и др. . FadD необходим для утилизации эндогенных жирных кислот, высвобождаемых из липидов мембран. J Bacteriol 193 , 6295–6304, https://doi.org/10.1128/JB.05450-11 (2011).
CAS Статья PubMed Central PubMed Google Scholar
Vadia, S. et al. . Наличие жирных кислот определяет емкость клеточной оболочки и размер микробных клеток. Curr Biol 27 , 1757–1767 e1755, https: // doi.org / 10.1016 / j.cub.2017.05.076 (2017).
CAS Статья PubMed Google Scholar
Перси, М. Г. и Грундлинг, А. Синтез и функция липотейхоевой кислоты у грамположительных бактерий. Annu Rev Microbiol 68 , 81–100, https://doi.org/10.1146/annurev-micro-0
-112949 (2014).
CAS Статья PubMed Google Scholar
Czekaj, T., Ciszewski, M. & Szewczyk, E. M. Staphylococcus haemolyticus — новая угроза на закате эпохи антибиотиков. Microbiology 161 , 2061–2068, https://doi.org/10.1099/mic.0.000178 (2015).
CAS Статья PubMed Google Scholar
Малахова Н. и ДеЛео Ф. Р. Мобильные генетические элементы Staphylococcus aureus. Cell Mol Life Sci 67 , 3057–3071, https: // doi.org / 10.1007 / s00018-010-0389-4 (2010).
CAS Статья PubMed Central PubMed Google Scholar
Отто, M. Коагулазонегативные стафилококки как резервуары генов, способствующих инфицированию MRSA: Комменсальные виды стафилококков, такие как Staphylococcus epidermidis, признаны важными источниками генов, способствующих колонизации и вирулентности MRSA. Bioessays 35 , 4–11, https: // doi.org / 10.1002 / bies.201200112 (2013).
CAS Статья PubMed Google Scholar
Отто М. Бактериальное зондирование антимикробных пептидов. Contrib Microbiol 16 , 136–149, https://doi.org/10.1159/000219377 (2009).
CAS Статья PubMed Central PubMed Google Scholar
Мацуо, М., Оогай, Ю., Като, Ф., Sugai, M. & Komatsuzawa, H. Зависимость от фазы роста чувствительности к антимикробным пептидам у Staphylococcus aureus. Microbiology 157 , 1786–1797, https://doi.org/10.1099/mic.0.044727-0 (2011).
CAS Статья PubMed Google Scholar
Lopalco, P., Stahl, J., Annese, C., Averhoff, B. & Corcelli, A. Идентификация уникальных видов кардиолипина и монолизокардиолипина в Acinetobacter baumannii. Sci Rep 7 , 2972, https://doi.org/10.1038/s41598-017-03214-w (2017).
ADS Статья PubMed Central PubMed Google Scholar
Фишер, Р. А., Голлан, Б. и Хелайн, С. Стойкие бактериальные инфекции и персистирующие клетки. Nat Rev Microbiol 15 , 453–464, https://doi.org/10.1038/nrmicro.2017.42 (2017).
CAS Статья PubMed Google Scholar
Танака, С. и др. . Mass ++: инструмент визуализации и анализа для масс-спектрометрии. J Proteome Res (2014).
Сравнение этиологической значимости Staphylococcus haemolyticus и Staphylococcus hominis
Grice EA, Kong HH, Renaud G, Young AC, NISC Comparative Sequencing Program, Bouffard GG et al (2008) Профиль разнообразия кожи человека микробиота. Genome Res 18: 1043–1050
Статья PubMed PubMed Central CAS Google Scholar
Kaspar U, Kriegeskorte A, Schubert T, Peters G, Rudack C, Pieper DH et al (2016) Культурома среды обитания человеческого носа выявляет индивидуальные образцы бактериальных отпечатков пальцев. Environ Microbiol 18: 2130–2142
Статья PubMed CAS Google Scholar
Холл К.К., Лайман Дж.А. (2006) Обновленный обзор заражения посевов крови. Clin Microbiol Rev 19: 788–802
Статья PubMed PubMed Central Google Scholar
Becker K, Heilmann C, Peters G (2014) Коагулазонегативные стафилококки. Clin Microbiol Rev 27: 870–926
Статья PubMed PubMed Central CAS Google Scholar
Ing MB, Baddour LM, Bayer AS (1997) Бактериемия и инфекционный эндокардит: патогенез, диагностика и осложнения. В: Crossley KB, Archer GL (eds) Стафилококки при заболеваниях человека. Churchill Livingstone Inc, Нью-Йорк, стр. 331–354
Google Scholar
Takeuchi F, Watanabe S, Baba T., Yuzawa H, Ito T, Morimoto Y et al (2005) Полногеномное секвенирование Staphylococcus haemolyticus раскрывает крайнюю пластичность его генома и эволюцию колонизирующих людей видов стафилококков. J Bacteriol 187: 7292–7308
Статья PubMed PubMed Central CAS Google Scholar
Hitzenbichler F, Simon M, Salzberger B, Hanses F (2017) Клиническое значение коагулазонегативных стафилококков, кроме S.epidermidis изолятов кровотока в больнице третичного уровня. Инфекция 45: 179–186
Статья PubMed CAS Google Scholar
Arciola CR, Campoccia D, An YH, Baldassarri L, Pirini V, Donati ME et al (2006) Распространенность и устойчивость к антибиотикам 15 второстепенных видов стафилококков, колонизирующих ортопедические имплантаты. Int J Artif Organs 29: 395–401
Статья PubMed CAS Google Scholar
von Eiff C, Arciola CR, Montanaro L, Becker K, Campoccia D (2006) Появление видов Staphylococcus в качестве новых патогенов при инфекциях имплантатов. Int J Artif Organs 29: 360–367
Статья Google Scholar
Soeorg H, Huik K, Parm U, Ilmoja ML, Metelskaja N, Metsvaht T. et al (2013) Генетическое родство коагулазонегативных стафилококков из желудочно-кишечного тракта и крови недоношенных новорожденных с поздним началом сепсиса.Pediatr Infect Dis J 32: 389–393
Статья PubMed Google Scholar
Чавес Ф., Гарсиа-Альварес М., Санс Ф., Альба С., Отеро Дж. Р. (2005) Нозокомиальное распространение Staphylococcus hominis subsp. novobiosepticus , вызывающий сепсис в отделении интенсивной терапии новорожденных. J Clin Microbiol 43: 4877–4879
Статья PubMed PubMed Central Google Scholar
Cunha BA, Esrick MD, Larusso M (2007) Staphylococcus hominis нативный бактериальный эндокардит митрального клапана (SBE) у пациента с гипертрофической обструктивной кардиомиопатией. Сердце легкое 36: 380–382
Статья PubMed Google Scholar
Palazzo IC, d’Azevedo PA, Secchi C, Pignatari AC, Darini AL (2008) Staphylococcus hominis subsp. novobiosepticus, вызывающие внутрибольничную инфекцию кровотока в Бразилии.J Antimicrob Chemother 62: 1222–1226
Статья PubMed CAS Google Scholar
Silva PV, Cruz RS, Keim LS, Paula GR, Carvalho BT, Coelho LR et al (2013) Антимикробная чувствительность, образование биопленок и генотипические профили Staphylococcus haemolyticus от инфекций кровотока. Mem Inst Oswaldo Cruz 108: 812–813
Статья PubMed PubMed Central CAS Google Scholar
Szczuka E, Telega K, Kaznowski A (2015) Формирование биопленки штаммами Staphylococcus hominis , выделенными из клинических образцов человека. Folia Microbiol (Praha) 60: 1–5
Статья CAS Google Scholar
Loyer M, Beaudet R, Bisaillon JG (1990) Сравнительное исследование гемолитических веществ, продуцируемых коагулазонегативными штаммами Staphylococcus . Infect Immun 58: 2144–2148
PubMed PubMed Central CAS Google Scholar
Da F, Joo HS, Cheung GYC, Villaruz AE, Rohde H, Luo X, Otto M (2017) Фенолорастворимые токсины модулялина Staphylococcus haemolyticus . Front Cell Infect Microbiol 7: 206
Статья PubMed PubMed Central Google Scholar
Angeletti S (2017) Матричная лазерная десорбционная времяпролетная масс-спектрометрия (MALDI-TOF-MS) в клинической микробиологии. J Microbiol Methods 138: 20–29
Статья PubMed CAS Google Scholar
Jo SJ, Park KG, Han K, Park DJ, Park YJ (2016) Прямая идентификация и тестирование на чувствительность к противомикробным препаратам бактерий из бутылочек с положительными культурами крови с помощью матричной лазерной десорбции / ионизации, времяпролетной масс-спектрометрии и Vitek 2 система. Ann Lab Med 36: 117–123
Статья PubMed CAS Google Scholar
Kassim A, Pflüger V, Preemji Z, Daubenberger C, Revathi G (2017) Сравнение основанной на биомаркерах матричной лазерной десорбционной ионизации-времяпролетной масс-спектрометрии (MALDI-TOF-MS) и традиционных методов идентификация клинически значимых бактерий и дрожжей.BMC Microbiol 17: 128
Статья PubMed PubMed Central Google Scholar
Trevisoli LE, Bail L, Rodrigues LS, Conte D, Palmeiro JK, Dalla-Costa LM (2018) Матричная лазерная десорбционная ионизация — время полета: многообещающий альтернативный метод выявления основных коагулазонегативных Виды стафилококков. Rev Soc Bras Med Trop 51: 85–87
Артикул PubMed Google Scholar
Баррос А.Дж., Хираката В.Н. (2003) Альтернативы логистической регрессии в поперечных исследованиях: эмпирическое сравнение моделей, которые непосредственно оценивают коэффициент распространенности. BMC Med Res Methodol 3:21
Статья PubMed PubMed Central Google Scholar
von Eiff C, Peters G, Heilmann C (2002) Патогенез инфекций, вызванных коагулазонегативными стафилококками. Lancet Infect Dis 2: 677–685
Статья Google Scholar
Seo SK, Venkataraman L, DeGirolami PC, Samore MH (2000) Молекулярное типирование коагулазонегативных стафилококков из посевов крови не коррелирует с клиническими критериями истинной бактериемии. Am J Med 109: 697–704
Статья PubMed CAS Google Scholar
Bouchami O, Ben Hassen A, de Lencastre H, Miragaia M (2011) Молекулярная эпидемиология метициллин-устойчивого Staphylococcus hominis (MRSHo): низкая клональность и резервуары структурных элементов SCCmec.PLoS One 6: e21940
Артикул PubMed PubMed Central CAS Google Scholar
Yeh CF, Chang SC, Cheng CW, Lin JF, Liu TP, Lu JJ (2016) Клинические особенности, исходы и молекулярные характеристики инфекций Staphylococcus lugdunensis, связанных с населением и здравоохранением. J Clin Microbiol 54: 2051–2057
Статья PubMed PubMed Central CAS Google Scholar
Deplano A, Vandendriessche S, Nonhoff C, Dodémont M, Roisin S, Denis O (2016) Национальное наблюдение за Staphylococcus epidermidis , вылеченным от инфекций кровотока в бельгийских больницах. J Antimicrob Chemother 71: 1815–1819
Статья PubMed CAS Google Scholar
Гемолитический стафилококк JCSC1435 | Центр биологических ресурсов, NITE (NBRC)
日本語 で 表示
Многие бактерии, принадлежащие к роду Staphylococcus, патогенны для человека, в том числе S.aureus наиболее опасен. Другие виды стафилококков менее вирулентны, но они также вызывают госпитальные инфекции, особенно у пациентов с ослабленным иммунитетом. S. haemolyticus, как известно, колонизирует кожу практически всех людей и обычно выделяется из подмышечных впадин, промежности и паховых областей и известен своей множественной лекарственной устойчивостью. Действительно, сообщалось, что именно эта бактерия приобрела устойчивость к метициллину и гликопептидным антибиотикам, таким как тейкопланин и ванкомицин, на исторически ранних стадиях.Кроме того, S. haemolyticus часто можно выделить из культур крови человека, и предполагается, что он вызывает сепсис, перитонит, отит и инфекции мочевыводящих путей.
Для выяснения механизма, ответственного за кажущуюся генетическую пластичность генома S. haemolyticus, которая может приводить к его фенотипу множественной лекарственной устойчивости, и для понимания его эволюционной связи с другими видами стафилококков, в частности двумя видами S. aureus, геномы которых были ранее проанализированы в NITE, полногеномное секвенирование S.haemolyticus JCSC1435. Размер генома составляет 2,69 МБ с содержанием G + C 32,8% и показывает примерно 40% общего сходства с геномами видов S. aureus. Он содержит три маленькие плазмиды. Одной из наиболее ярких особенностей генома этой бактерии является его богатство повторяющимися последовательностями, включая большое количество и разнообразие инсерционных последовательностей (IS), а также других типов повторов. Длина этих повторов составляет около 5% генома. Предполагается, что некоторые из идентифицированных таким образом IS могли быть вовлечены в передачу устойчивости к антибиотикам другим родственным видам стафилококков.
Предоставлено
Доктор Хирамацу (Джунтендо унив.)
| хромосома | pSHaeA | pSHaeB | pSHaeC | всего | |
|---|---|---|---|---|---|
| Размер генома (бит / с) | 2 685 015 | 2 300 | 2,366 | 8,180 | 2 697 861 |
| Количество ORF | 2 678 | 3 | 2 | 11 | 2 694 |
| Содержание GC (%) | 32.8 | 29,9 | 31,1 | 30,3 | 32,8 |
| Опубликованная статья | Полногеномное секвенирование Staphylococcus haemolyticus раскрывает крайнюю пластичность его генома и эволюцию видов стафилококков, колонизирующих человека | ||||
| Бактериологический журнал 187 (21) , 7292-7308 (2005) | |||||
| База данных генома | ДОГАН | ||||
pSHaeA, pSHaeB и pSHaeC являются плазмидами.
Свяжитесь с нами
- Подразделение промышленных инноваций, Центр биологических ресурсов, Национальный институт технологий и оценки
-
Адрес: 2-49-10 Нишихара, Сибуя-ку, Токио, 151-0066 КАРТА ЯПОНИИ
Контактная форма
% PDF-1.4 % 1 0 объект > эндобдж 2 0 obj > поток 2015-06-26T11: 01: 38 + 01: 002015-06-26T11: 01: 35 + 01: 002015-06-26T11: 01: 38 + 01: 00uuid: baa326cc-cfc6-7a4f-97ba-166d6ce9f677uuid: 484fe071- cc53-674b-80e8-ddacac95787aapplication / pdf Библиотека Adobe PDF 9.1 конечный поток эндобдж 3 0 obj > эндобдж 6 0 obj > эндобдж 7 0 объект > эндобдж 17 0 объект > / Font> / ProcSet [/ PDF / Text / ImageC] / XObject >>> / Type / Page >> эндобдж 18 0 объект > поток HWnWpm @ eVD? H [$ v \ Η | zrn = $ ϝF (D2ea F? Y ߰_?% 75 + 刱 | Ò ߟ: FjiY’Fū1} ū [f *> WFL? -OpN: CtO ۮ ^ ~ 0N [^.
