Кетоны — Википедия
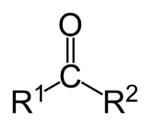
Кето́ны — органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
Общая формула кетонов: R1-CO-R2.
Среди других карбонильных соединений наличие в кетонах именно двух атомов углерода, непосредственно связанных с карбонильной группой, отличает их от карбоновых кислот и их производных, а также альдегидов.
Слово кетон произошло от старого немецкого слова Aketon (ацетон). Придумал его в 1848 году немецкий химик Леопольд Гмелин (1788—1853)[1].
Названия алифатических и алициклических кетонов образуют, прибавляя суффикс -он или -дион (для дикетонов) к названию родоночального углеводорода. Дикетоны ароматического ряда с кетонными группами в ядре называют сокращённым названием углеводорода, добавляя суффикс -хинон
Другие номенклатуры[править | править код]
Тривиальная номенклатура. Для простейших кетонов используются их тривиальные названия, например, ацетон (для 2-пропанона) и бензофенон (для дифенилкетона).
Радикало-функциональная номенклатура. Допускается название кетонов по радикально-функциональной номенклатуре, при этом название составляется из радикалов при кетогруппе (в алфавитном порядке) и названия класса соединений (функции) —кетон (например, метилэтилкетон — CH3-CO-CH2-CH3).
Ацетон был открыт Робертом Бойлем в 1661 году при нагревании ацетата кальция (ацетон происходит от лат. acetum — уксус):
- Ca(Ch4COO)2→t(Ch4)2CO+CaCO3{\displaystyle {\mathsf {Ca(CH_{3}COO)_{2}{\xrightarrow {t}}{}(CH_{3})_{2}CO+CaCO_{3}}}}
Похожая реакция была описана Андреасом Либавием — ацетон образовывался при нагревании свинцового сахара (ацетата свинца(II)). Установить состав этого вещества удалось только в 1852 году Александру Уильяму Уильямсону[3].
Кетоны — летучие жидкости или легкоплавкие твёрдые вещества, низшие представители хорошо растворимы в воде и смешиваются с органическими растворителями, некоторые (ацетон) смешиваются с водой в любых соотношениях. Невозможность образования межмолекулярных водородных связей обуславливает несколько бо́льшую их летучесть, чем у спиртов и карбоновых кислот с той же молекулярной массой (например, ацетон кипит при 56,1 °C, а пропанол-2 — при 82,4 °C).
- Циклокетоны можно получить циклизацией Ружички.
- Гидратация гомологов ацетилена (реакция Кучерова).
- Кетоны с хорошими выходами получаются при взаимодействии хлорангидридов кислот с диалкилкупратами лития и алкилкадмиевыми соединениями:
- R2CuLi+R′COCl→RC(O)R′+LiCl+CuR{\displaystyle {\mathsf {R_{2}CuLi+R’COCl\rightarrow RC(O)R’+LiCl+CuR}}}
- 2RCOCl+Cd(C2H5)2→2RC(O)C2H5+CdCl2{\displaystyle {\mathsf {2RCOCl+Cd(C_{2}H_{5})_{2}\rightarrow 2RC(O)C_{2}H_{5}+CdCl_{2}}}}
Кето-енольная таутомерия[править | править код]

Кетоны, которые имеют по крайней мере один альфа-водородный атом, подвергаются кето-енольной таутомеризации. Таутомеризация катализируется как кислотами, так и основаниями. Как правило, кето-форма является более стабильной, чем енольная. Это равновесие позволяет получать кетоны путём гидратации алкинов. Относительная стабилизация енольной формы сопряжением является причиной довольно сильной кислотности кетонов (pKa ≈ 20) в сравнении с алканами (pK
Гидрирование[править | править код]
Присоединение водорода к кетонам происходит в присутствии катализаторов гидрирования (Ni, Co, Cu, Pt, Pd и др.). В последнее время в качестве гидрирующего агента часто используют алюмогидрид лития. При этом кетоны превращаются во вторичные спирты:
- R2CO+2H→R2CH(OH){\displaystyle {\mathsf {R_{2}CO+2H\rightarrow R_{2}CH(OH)}}}
При восстановлении кетонов водородом в момент выделения (с помощью щелочных металлов или амальгамы магния) образуются также гликоли (пинаконы):
- 2R2CO+2H→R2C(OH)−CR2(OH){\displaystyle {\mathsf {2R_{2}CO+2H\rightarrow R_{2}C(OH){-}CR_{2}(OH)}}}
Реакции нуклеофильного присоединения[править | править код]
- (Ch4)2CO+HCN→(Ch4)2C(OH)CN{\displaystyle {\mathsf {(CH_{3})_{2}CO+HCN\rightarrow (CH_{3})_{2}C(OH)CN}}}
- (Ch4)2C(OH)CN+2h3O→(Ch4)2C(OH)COOH+Nh4{\displaystyle {\mathsf {(CH_{3})_{2}C(OH)CN+2H_{2}O\rightarrow (CH_{3})_{2}C(OH)COOH+NH_{3}}}}
- (Ch4)2CO→OH−(Ch4)2C=CH−C(O)−Ch4→+Nh4(Ch4)2C(Nh3)Ch3−C(O)−Ch4{\displaystyle {\mathsf {(CH_{3})_{2}CO{\xrightarrow[{OH-}]{}}(CH_{3})_{2}C{=}CH{-}C(O){-}CH_{3}{\xrightarrow[{+NH_{3}}]{}}(CH_{3})_{2}C(NH_{2})CH_{2}{-}C(O){-}CH_{3}}}}
- Присоединение гидросульфита натрия даёт гидросульфитные (бисульфитные) производные (в реакцию в жирном ряду вступают лишь метилкетоны):
- RC(O)Ch4+HSO3Na→R−C(OH)(SO3Na)−Ch4{\displaystyle {\mathsf {RC(O)CH_{3}+HSO_{3}Na\rightarrow R{-}C(OH)(SO_{3}Na){-}CH_{3}}}}
При нагревании с раствором соды или минеральной кислотой гидросульфитные производные разлагаются с выделением свободного кетона:
- 2R−C(OH)(SO3Na)−Ch4+Na2CO3→2RC(O)Ch4+2Na2SO3+CO2+h3O{\displaystyle {\mathsf {2R{-}C(OH)(SO_{3}Na){-}CH_{3}+Na_{2}CO_{3}\rightarrow 2RC(O)CH_{3}+2Na_{2}SO_{3}+CO_{2}+H_{2}O}}}
- (Ch4)2CO+Nh3OH→h3O+(Ch4)2C=N−OH{\displaystyle {\mathsf {(CH_{3})_{2}CO+NH_{2}OH\rightarrow H_{2}O+(CH_{3})_{2}C{=}N{-}OH}}}
- (Ch4)2CO+N2h5→(Ch4)2C=N−Nh3+h3O{\displaystyle {\mathsf {(CH_{3})_{2}CO+N_{2}H_{4}\rightarrow (CH_{3})_{2}C{=}N{-}NH_{2}+H_{2}O}}}
- 2(Ch4)2CO+N2h5→(Ch4)2−C=N−N=C−(Ch4)2+2h3O{\displaystyle {\mathsf {2(CH_{3})_{2}CO+N_{2}H_{4}\rightarrow (CH_{3})_{2}-C{=}N{-}N{=}C-(CH_{3})_{2}+2H_{2}O}}}
Как и в случае альдегидов, при нагревании с твёрдым KOH гидразоны кетонов выделяют азот и дают предельные углеводороды (реакция Кижнера)
- Ацетали кетонов получаются сложнее, чем ацетали альдегидов, — действием на кетоны эфиров ортомуравьиной HC(OC2H5)3 или ортокремниевой кислоты.
Реакции конденсации[править | править код]
В жёстких условиях (в присутствии щелочей) кетоны подвергаются альдольной конденсации. При этом образуются β-кетоспирты, легко теряющие молекулу воды.
В ещё более жестких условиях, например при нагревании с концентрированной серной кислотой, кетоны подвергаются межмолекулярной дегидратации с образованием непредельных кетонов:
- 2(Ch4)2CO→h3O+(Ch4)2C=CH−C(O)−Ch4{\displaystyle {\mathsf {2(CH_{3})_{2}CO\rightarrow H_{2}O+(CH_{3})_{2}C{=}CH{-}C(O){-}CH_{3}}}}
Окись мезитила может реагировать с новой молекулой ацетона с образованием форона:
- (Ch4)2C=CH−C(O)−Ch4+(Ch4)2CO→(Ch4)2C=CH−C(O)−CH=C(Ch4)2{\displaystyle {\mathsf {(CH_{3})_{2}C{=}CH{-}C(O){-}CH_{3}+(CH_{3})_{2}CO\rightarrow (CH_{3})_{2}C{=}CH{-}C(O){-}CH{=}C(CH_{3})_{2}}}}
Токсичны. Обладают раздражающим и местным действием, проникают через кожу, особенно хорошо ненасыщенные алифатические. Отдельные вещества обладают канцерогенным и мутагенным эффектом. Галогенпроизводные кетонов вызывают сильное раздражение слизистых оболочек и ожоги при контакте с кожей. Алициклические кетоны обладают наркотическим действием.
Кетоны играют важную роль в метаболизме веществ в живых организмах. Так, убихинон участвует в окислительно-восстановительных реакциях тканевого дыхания. К соединениям, содержащим кетонную группу, относятся некоторые важные моносахариды (фруктоза и др.), терпены (ментон, карвон), компоненты эфирных масел (камфора, жасмон), природные красители (индиго, ализарин, флавоны), стероидные гормоны (кортизон, прогестерон), мускус (мускон), антибиотик тетрациклин.
В процессе фотосинтеза 1,5-дифосфат-D-эритро-пентулозы (фосфолированная кетопентоза) является катализатором. Ацетоуксусная кислота — промежуточный продукт в цикле Кребса.
Наличие в моче и крови человека кетонов говорит о гипергликемии, различных расстройствах метаболизма или кетоацидозе.
В промышленности кетоны используют как растворители, фармацевтические препараты и для изготовления различных полимеров. Важнейшими кетонами являются ацетон, метилэтиловый кетон и циклогексанон[5].
- Общая токсикология / под ред. А. О. Лойта. Спб.: ЭЛБИ-СПб., 2006
- Химическая Энциклопедия в 5 томах ред. И. Л. Кнунянц 2 том
Кетоны
Общая формула и название
Общая формула кетонов: R1-CO-R2.
По номенклатуре ИЮПАК, названия кетонов образуют путем присоединения к названию соответствующих углеводородов суффикса «он» или к названию радикалов, связанных с кетогруппой С=О, слова «кетон»; при наличии старшей группы кетогруппу обозначают префиксом «оксо». Например, соединения СН3-СН2-СО-СН2-СН2-СН3 называется 3-гексанон или этилпропилкетон, соединения СН3-СО-СН2-СН2-СООН — 4-оксопентановая кислота. Для некоторых кетонов приняты тривиальные названия.
Среди других карбонильных соединений наличие в кетонах именно двух атомов углерода, непосредственно связанных с карбонильной группой, отличает их от карбоновых кислот и их производных, а также альдегидов.
Особый класс циклических ненасыщенных дикетонов — хиноны.
Физические свойства
Простейшие кетоны являются бесцветными, летучими жидкостями, которые растворяются в воде. Кетоны обладают приятным запахом. Высшие кетоны — твердые, легкоплавкие вещества. Газообразных кетонов не бывает, так как уже простейший из них (ацетон) — жидкость. Многие химические свойства, характерные для альдегидов, проявляюся и у кетонов.
Кето-енольная таутомерия
Таутомерия — тип изомерии, при которой происходит быстрое самопроизвольное обратимое взаимопревращение структурных изомеров — таутомеров. Процесс взаимопревращения таутомеров называется таутомеризацией.
Кетоны, которые имеют по крайней мере один α-водородный атом, подвергаются кето-енольной таутомеризации.
Для оксосоединений, имеющих атом водорода в α-положении по отношннию к карбонильной группе, существует равновесие между таутомерными формами. Для подавляющего большинства оксосоединений это равновесие смещено в сторону кето-формы. Процесс перехода кето-формы в енольную называют енолизацией . На этом основана способность таких кетонов реагировать как С-или О-нуклеофилы. Концентрация енольной формы зависит от строения кетонов и составляет (в %): 0,0025 (ацетон), 2 (циклогексанон), 80 (ацетилацетон). Скорость енолизации возрастает в присутствии кислот и оснований.
Химические свойства
По степени окисленности кетоны, как и альдегиды, занимают промежуточное положение между спиртами и кислотами, что во многом определяет их химические свойства. 1. Кетоны восстанавливаются до вторичных спиртов гидридами металлов, например LiAlH4 или NaBH4, водородом (кат. Ni, Pd), изопропанолом в присутствии алкоголята Аl (реакцияция Меервейна-Понндорфа-Верлея).
R2CO + 2H → R2CH(OH)
2. При восстановлении кетонов натрием или электрохимически (катодное восстановление) образуются пинаконы.
2R2CO + 2H → R2CH(OH)-CR2(OH)
3. При взаимодействии кетонов с амальгамированным Zn и концентрированной НCl (реакция Клемменсена) или с гидразином в щелочной среде (реакция Кижнера — Вольфа) группа С=О восстанавливается до СН2.
4. Окисление кетонов
В отличие от альдегидов, многие кетоны устойчивы при хранении к действию кислорода. Кетоны, содержащие α-метиленовую группу, окисляются SeO2 до 1,2-дикетонов, более энергичными окислителями, напр. КМnО4 — до смеси карбоновых кислот. Циклические кетоны при взаимодействии с HNO3 или КМnО4 подвергаются окислительному расщеплению цикла, например, из циклогексанона образуется адипиновая кислота. Линейные кетоны окисляются надкислотами до сложных эфиров, циклические — до лактонов (реакция Байера — Виллигера).
Если в качестве окислителя используют, например, хромовую смесь (смесь концентрированной серной кислоты и насыщенного раствора дихромата калия) при нагревании. Окисление кетонов всегда сопровождается разрывом углерод-углеродных связей, в результате образуется, в зависимости от строения исходного кетона, смесь кислот и кетонов с меньшим числом атомов углерода. Окисление протекает по схеме:
В первую очередь окисляется углерод в α-положении по отношению к карбонильной группе, как правило, наименее гидрогенизированный. Если кетон является метилкетоном, то одним из продуктов его окисления будет углекислый газ. Связь между соседними карбонильными углеродами легко рвется, в результате:
Окисление кетонов до карбоновых кислот не может происходить без расщепления углеродного скелета и требует более жестких условий, чем окисление альдегидов. А. Н. Попов, изучавший окисление кетонов, показал, что из несимметрично построенного кетона при окислении могут образоваться все четыре возможные карбоновые кислоты (правило Попова):
Если кетон содержит в α-положении третичный углеродный атом, то в результате окисления образуются три карбоновые кислоты и новый кетон, который в зависимости от условий может или подвергнуться дальнейшему окислению, или остаться неизмененным:
5. Альдольная и кретоновая конденсации
Кетоны образуют продукты замещения α-атомов Н при галогенировании действием Вr2, N-бромсукцинимидом, SO2Cl2, при тиилировании дисульфидами. При алкилировании и ацилировании енолятов кетонов образуются либо продукты замещения α-атомов Н в кетонах, либо О-производные енолов. Большое значение в органическом синтезе имеют альдольная и кретоновая конденсации, например:
При конденсации с альдегидами кетоны реагируют главным образом как СН-кислоты, например из кетонов и СН2О в присутствии основания получают α, β-ненасыщенные кетоны:
RCOCH3 + СН2О → RCOCH=CH2 + Н2О
Вследствие полярности карбонильной группы
кетоны могут вступать в реакции как С-электрофилы, например при конденсации с производными карбоновых кислот (конденсация Штоббе, реакция Дарзана и т. п.):
(CH3)2CO + (C2H5OOCCH2)2 + (CH3)3COK → (CH3)2=C(COOC2H5)CH2COOK + C2H5OH + (CH3)3COH
Особенно легко нуклеофильной атаке подвергаются α,β-непределъные кетоны, но в этом случае атакуется двойная связь (раекция Михаэля), например:
6. Взаимодействие с илидами
При взаимодействии с илидами Р (алкилиденфосфоранами) кетоны обменивают атом О на алкилиденовую группу (реакция Виттига):
R2C=O + Ph3P=CHR’ → R2C=CHR’ + Ph3PO
7. С циклопентадиеном кетоны образуют фульвены, например:
8. При конденсации кетонов с гидроксиламином получаются кетоксимы R2C=NOH, с гидразином — гидразоны R2C=N—NH2 и азины R2C=N—N=CR2, с первичными аминами — Шиффовы основания R2C=NR’, со вторичными аминами — енамины.
9. Присоединение по карбонильной групе
Кетоны способны присоединять по карбонильной группе воду, спирты, бисульфит Na, амины и другие нуклеофилы, хотя эти реакции протекают не так легко, как в случае альдегидов.
Поскольку в спиртовых растворах равновесие между кетоном и его полукеталем сильно смещено влево, получить кетали из кетонов и спиртов трудно:
RCOR’ + R»OH ↔ RR’C(OH)OR»
Для этой цели используют реакцию кетонов с эфирами ортомуравьиной кислоты. Кетоны взаимодействуют с С-нуклеофилами, например с литий-, цинк- или магнийорганические соединения, а также с ацетиленами в присутствии оснований (реакция Фаворского), образуя третичные спирты:
В присутствии оснований к кетонам присоединяется HCN, давая α-гидроксинитрилы (циангидрины):
R2C=O + HCN → R2C(OH)CN
При катализе кислотами кетоны реагируют как С-электрофилы с ароматическими соединениями, например:
Гомолитическое присоединение кетонов к олефинам приводит к α-алкилзамещенным кетонам, фотоциклoприсоединение к оксетанам, например:
Получение кетонов
Кетоны могут быть получены окислением вторичных спиртов. Окислителем, обычно применяемым для этой цели в лабораториях, является хромовая кислота, употребляемая чаще всего в виде «хромовой смеси» (смесь бихромата калия или натрия с серной кислотой). Иногда применяются также перманганаты различных металлов или перекись марганца и серная кислота.
При пропускании паров спирта через нагретые трубки с мелко раздробленной, восстановленной водородом металлической медью вторичные спирты распадаются — на кетон и водород. Несколько хуже эта реакция проходит в присутствии никеля, железа или цинка.
Кетоны могут быть получены сухой перегонкой кальциевых и бариевых солей одноосновных кислот. Для всех кислот, кроме муравьиной, реакция идет следующим образом:
Чаще восстанавливают не самые кислоты, а их производные, например хлорангидриды:
CH3-CO-Cl + 2H → CH3-CHO + HCl
т. е. образуется кетон с двумя одинаковыми радикалами и карбонат кальция.
Если взять смесь солей двух кислот или смешанную соль, то наряду с предыдущей реакцией происходит также реакция между молекулами разных солей:
Вместо сухой перегонки готовых солей используют также контактный способ, так называемую реакцию кетонизации кислот, состоящую в том, что пары кислот пропускают при повышенной температуре над катализаторами, в качестве которых применяют углекислые соли кальция или бария, закись марганца, окись тория, окись алюминия и др.
Здесь сначала образуются соли органических кислот, которые затем разлагаются, регенерируя вещества, являющиеся катализаторами. В результате реакция идет, например, для уксусной кислоты по следующему уравнению:
2CH3-COOH → CH3-CO-CH3 + H2O + CO2
Кетоны могут получаться при взаимодействии с водой дигалоидных соединений, содержащих оба атома галоида при одном и том же атоме углерода. При этом можно было бы ожидать обмена атомов галоида на гидроксилы и получения двухатомных спиртов, у которых обе гидроксильные группы находятся при одном и том же атоме углерода, например:
Но такие двухатомные спирты в обычных условиях не существуют, они отщепляют молекулу воды, образуя кетоны:
При действии воды на гомологи ацетилена в присутствии солей окиси ртути, получаются кетоны:
CH3-C≡CH + H2O → CH3-CO-CH3
При взаимодействии производных карбоновых кислот с некоторыми металлоорганическими соединениями присоединение одной молекулы металлоорганического соединения по карбонильной группе протекает по схеме:
Если на полученные соединения подействовать водой, то они реагируют с ней с образованием в кетонов:
При действии на амид кислоты двух молекул магнийорганического соединения, а затем воды получаются кетоны без образования третичных спиртов:
Кадмийорганические соединения взаимодействуют с хлорангидридами кислот иначе, чем магний- или цинкорганические:
R-CO-Cl + C2H5CdBr → R-CO-C2Н5 + CdClBr
Поскольку кадмийорганические соединения не вступают в реакцию с кетонами, здесь не могут получаться третичные спирты.
Применение кетонов
В промышленности кетоны используют как растворители, фармацевтические препараты и для изготовления различных полимеров. Важнейшими кетонами являются ацетон, метилэтиловый кетон и циклогексанон.
Физиологическое действие
Токсичны. Обладают раздражающим и местным действием, проникают через кожу, особенно хорошо ненасыщенные алифатические. Отдельные вещества обладают канцерогенным и мутагенным эффектом. Галогенпроизводные кетонов вызывают сильное раздражение слизистых оболочек и ожоги при контакте с кожей. Алициклические кетоны обладают наркотическим действием.
Кетоны играют важную роль в метаболизме веществ в живых организмах. Так, убихинон участвует в окислительно-восстановительных реакциях тканевого дыхания. К соединениям, содержащим кетонную группу, относятся некоторые важные моносахариды (фруктоза и др.), терпены (ментон, карвон), компоненты эфирных масел (камфора, жасмон), природные красители (индиго, ализарин, флавоны), стероидные гормоны (кортизон, прогестерон), мускус (мускон), антибиотик тетрациклин.
В процессе фотосинтеза 1,5-дифосфат-D-эритро-пентулозы (фосфолированная кетопентоза) является катализатором. Ацетоуксусная кислота — промежуточный продукт в цикле Креббса.
Наличие в моче и крови человека кетонов говорит о гипогликемии, различных расстройствах метаболизма или кетоацидозе.
Кетоны: химические свойства и определение
Органическая химия — наука весьма сложная, но интересная. Ведь соединения одних и тех же элементов, в разном количестве и последовательности способствует образованию различных по свойствам веществ. Давайте рассмотрим соединения карбонильной группы под названием «кетоны» (химические свойства, физические особенности, методы их синтеза). А также сравним их с другими веществами этого же рода – альдегидами.
Кетоны
Это слово является общим названием для целого класса веществ органической природы, в молекулах которых карбонильная группа (С=О) связана с двумя углеродными радикалами.
По своему строению кетоны близки к альдегидам и карбоновым кислотам. Однако в них присутствуют сразу два атома С (карбон или углерод), соединенных с С=О.
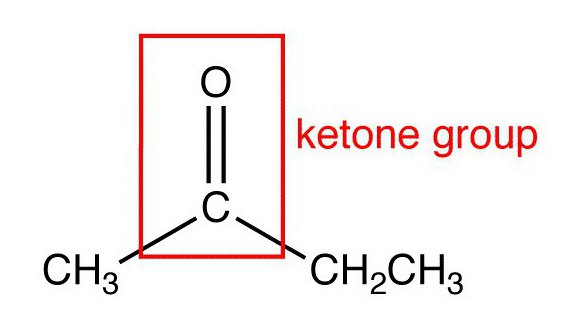
Формула
Общая формула веществ этого класса выглядит следующим образом: R1-CO-R2.
Чтобы она была более понятна, как правило, ее записывают так.
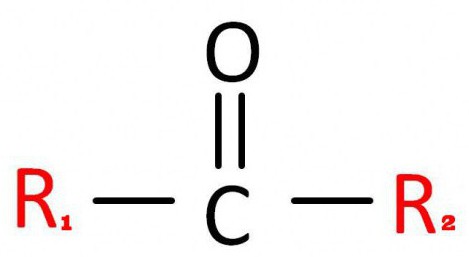
В ней С=О – это карбонильная группа. А R1 иR2– это углеродные радикалы. На их месте могут быть различные соединения, но в их составе обязательно должен быть углерод.
Альдегиды и кетоны
Физические и химические свойства этих групп веществ довольно схожи между собой. По этой причине их часто рассматривают вместе.
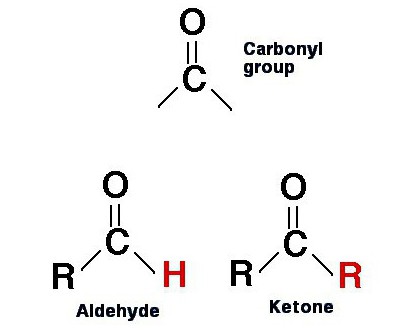
Дело в том, что альдегиды тоже содержат в своих молекулах карбонильную группу. У них с кетонами даже формулы весьма схожи. Однако если у рассматриваемых веществ С=О присоединяется к 2 радикалам, то у альдегидов он только один, вместо второго — атом гидрогена: R-CO-H.
В качестве примера можно привести формулу вещества этого класса – формальдегида, более известного всем, как формалин.
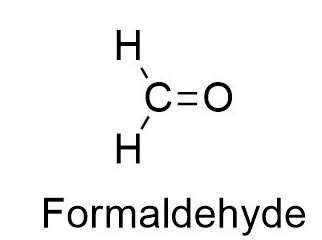
Исходя из формулы CH2O, видно, что его карбонильная группа связана не с одним, а сразу с двумя атомами Н.
Физические свойства
Прежде чем разобраться с химическими свойствами альдегидов и кетонов, стоит рассмотреть их физические особенности.
- Кетоны – это легкоплавкие твердые вещества или жидкости с летучестью. Низшие представители этого класса отлично растворяются в Н2О и неплохо взаимодействуют с растворителями органического происхождения.
Отдельные представители (например, СН3СОСН3) замечательно растворяются в воде, причем абсолютно в любых пропорциях.
В отличие от спиртов и карбоновых кислот, кетоны обладают большей летучестью, при одинаковой молекулярной массе. Этому способствует невозможность этих соединений создавать связи с Н, как это могут H-CO-R. - Разные виды альдегидов могут пребывать в различных агрегатных состояниях. Так высшие R-CO-H – это нерастворимые твердые вещества. Низшие — это жидкости, часть из которых отлично смешивается с Н2О, однако отдельные из них только растворимы в воде, но не более.
Простейший из веществ данного вида – муравьиный альдегид – это газ, которому свойственен острый запах. Данное вещество отлично растворимо в Н2О.
Наиболее известные кетоны
Существует немало веществ R1-CO-R2, однако известных из них не так уж много. В первую очередь это диметилкетон, который мы все знаем как ацетон.
 Также его коллега-растворитель — бутанон или как его правильно называть — метилэтилкетон.
Также его коллега-растворитель — бутанон или как его правильно называть — метилэтилкетон.Среди других кетонов, химические свойства которых активно используются в промышленности – ацетофенон (метилфенилкетон). В отличие от ацетона и бутанона, его запах довольно приятен, из-за чего он используется в парфюмерии.
К примеру, циклогексанон относится к типичным представителям R1-CO-R2, и чаще всего используется в производстве растворителей.
Нельзя не упомянуть о дикетонах. Такое название носят R1-CO-R2, у которых не одна, а две карбонильные группы в составе. Таким образом, их формула выглядит: R1-CO-CO-R2. Одним из наиболее простых, но широко используемых в пищевой промышленности представителей дикетонов является диацетил (2,3-бутандион).
Перечисленные вещества – это всего лишь небольшой список синтезированных учеными кетонов (химические свойства рассмотрены ниже). На самом деле их больше, но не всем найдено применение. Тем более стоит учитывать то, что многие из них токсичны.
Химические свойства кетонов
Вещества данной категории способны вступать в реакции с различными веществами. Именно это и является их особенными химическими свойствами.
- Кетоны способны присоединять к себе Н (реакция гидрирования). Однако для произведения этой реакции необходимо присутствие катализаторов в виде атомов металлов никеля, кобальта, купрума, платины, палладия и других. В результате реакции R1-CO-R2 эволюционируют до вторичных спиртов.
Также при взаимодействии с гидрогеном в присутствии щелочных металлов или амальгамы Mg из кетонов получаются гликоли. - Кетоны, обладающие хотя бы одним альфа-гидрогенным атомом, как правило, попадают под воздействие таутомеризации кето-енольной. Она катализируется не только с помощью кислот, но и основ. Обычно кето-форма являет собою более стабильное явление, нежели енольная. Данное равновесие дает возможность синтезировать кетоны путем гидратации алкинов. Относительная стабилизация енольной кето-формы сопряжением приводит к довольно сильной кислотности R1-CO-R2 (если сравнивать их с алканами).
- Данные вещества могут вступать в реакции с аммиаком. Однако они протекают весьма медленно.
- Кетоны взаимодействуют с синильной кислотой. В результате возникают α-оксинитрилы, омыление которых способствует появлению α-гидроксикислот.
- Вступление в реакцию с алкилмагнийгалогенидами приводит к формированию вторичных спиртов.
- Присоединение к NaHSO3способствует возникновению гидросульфитных (бисульфитных) производных. Стоит помнить, что в реакцию в жирном ряду вступать способны лишь метилкетоны.
Помимо кетонов, подобно взаимодействовать с гидросульфитом натрия могут и альдегиды.
При нагревании с раствором NaHCO3 (пищевая сода) или минеральной кислотой, производные от NaHSO3 могут разлагаться, сопровождаясь выделением свободного кетона. - В процессе реакции R1-CO-R2с NH2OH (гидроксиламин) образуются кетоксимы и как побочный продукт – Н2О.
- При реакциях с участием гидразина образуются гидразоны (соотношение взятых веществ — 1:1) или азины (1:2).
Если полученный из-за реакции продукт (гидразон) под действием температуры прореагирует с едким калием, выделиться N и предельные углеводороды. Данный процесс именуется реакцией Кижнера. - Как уже было сказано выше, альдегиды и кетоны химические свойства и получения процесс имеют похожие. При этом ацетали R1-CO-R2 образуются более сложные, нежели ацетали R-CO-H. Они появляются в результате действия на кетоны эфиров ортомуравьиной и ортокремниевой кислот.
- В условиях с большей концентрацией щелочей (к примеру, при нагревании с концентрированной H₂SO₄) R1-CO-R2 подвергаются межмолекулярной дегидратации с формированием непредельных кетонов.
- Если в реакции с R1-CO-R2 присутствуют щелочи, кетоны подвергаются альдольной конденсации. Вследствие этого образуются β-кетоспирты, способные с легкостью лишаться молекулы Н2О.
- Довольно показательно проявляют себя химические свойства кетонов на примере ацетона, прореагировавшего с окисью мезитила. В таком случае образуется новое вещество под названием «форон».
- Также к химическим свойствам рассматриваемого органического вещества можно отнести реакцию Лейкарта-Валлаха, которая способствует восстановлению кетонов.
Из чего получают R1-CO-R2
Ознакомившись со свойства рассматриваемых веществ, стоит узнать наиболее распространенные способы их синтеза.
- Одной из наиболее известных реакций для получения кетонов является алкилирование и ацилирование ароматических соединений в присутствии катализаторов кислотного характера ( AlCl3, FeCI3, минеральных кислот, окислов, катионообменных смол и т.п.). Данный способ известен под названием реакция Фриделя-Крафтса.
- Кетоны синтезируются при помощи гидролиза кетиминов и виц-диолов. В случае с последними необходимо присутствие минеральных кислот как катализаторов.
- Также для получения кетонов применяется гидратация гомологов ацетилена или как ее называют — реакция Кучерова.
- Реакции Губена-Геша.
- Циклизация Ружички пригодна для синтеза циклокетонов.
- Также данные вещества добывают из третичных пероксоэфиров при помощи перегруппировки Криге.
- Существует несколько способов синтеза кетонов во время реакций окисления вторичных спиртов. В зависимости от действующего соединения выделяются 4 реакции: Сверна, Корнблюма, Кори-Кима и Парика-Деринга.
Сфера применения
Разобравшись с химическими свойствами и получением кетонов, стоит узнать, где же используются данные вещества.

Как уже упоминалось выше, большинство из них используется в химической промышленности в качестве растворителей для лаков и эмалей, а также при производстве полимеров.
Помимо этого, некоторые R1-CO-R2неплохо зарекомендовали себя как ароматизаторы. В таком качестве кетоны (бензофенон, ацетофенон и другие) применяются в парфюмерии и кулинарии.
Также ацетофенон используется как компонент для изготовления снотворного.

Бензофенон, благодаря способности поглощать вредное излучение, – является частым ингредиентом антизагарной косметики и одновременно консервантом.
Влияния R1-CO-R2 на организм
Узнав, что за соединения называются кетонами (химические свойства, применение, синтез и другие данные о них), стоит ознакомиться с биологическими особенностями данных веществ. Иными словами, узнать, как же они действуют на живые организмы.
Несмотря на довольно частое использования R1-CO-R2 в промышленности, стоит всегда помнить, что такие соединения очень токсичны. Многие из них обладают канцерогенными и мутагенными свойствами.
Особые представители способны вызывать раздражение на слизистых оболочках, вплоть до ожогов. Алициклические R1-CO-R2 могут воздействовать на организм, как наркотики.
Однако не все вещества такого рода вредны. Дело в том, что некоторые из них принимают активное участие в метаболизме биологических организмов.
Также кетоны – это своеобразные маркеры нарушений углеродного обмена и дефицита инсулина. При анализе мочи и крови присутствие R1-CO-R2 свидетельствует о различных расстройствах метаболизма, в том числе гипергликемии и кетоацидозе.
Кетоны Википедия
Кето́ны — органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
Общая формула кетонов: R1-CO-R2.
Среди других карбонильных соединений наличие в кетонах именно двух атомов углерода, непосредственно связанных с карбонильной группой, отличает их от карбоновых кислот и их производных, а также альдегидов.
Этимология
Слово кетон произошло от старого немецкого слова Aketon (ацетон). Придумал его в 1848 году немецкий химик Леопольд Гмелин (1788—1853)[1].
Номенклатура
Названия алифатических и алициклических кетонов образуют, прибавляя суффикс -он или -дион (для дикетонов) к названию родоночального углеводорода. Дикетоны ароматического ряда с кетонными группами в ядре называют сокращённым названием углеводорода, добавляя суффикс -хинон[2].
Другие номенклатуры
Тривиальная номенклатура. Для простейших кетонов используются их тривиальные названия, например, ацетон (для 2-пропанона) и бензофенон (для дифенилкетона).
Радикало-функциональная номенклатура. Допускается название кетонов по радикально-функциональной номенклатуре, при этом название составляется из радикалов при кетогруппе (в алфавитном порядке) и названия класса соединений (функции) —кетон (например, метилэтилкетон — CH3-CO-CH2-CH3).
История открытия кетонов
Ацетон был открыт Робертом Бойлем в 1661 году при нагревании ацетата кальция (ацетон происходит от лат. acetum — уксус):
- Ca(Ch4COO)2→t(Ch4)2CO+CaCO3{\displaystyle {\mathsf {Ca(CH_{3}COO)_{2}{\xrightarrow {t}}{}(CH_{3})_{2}CO+CaCO_{3}}}}
Похожая реакция была описана Андреасом Либавием — ацетон образовывался при нагревании свинцового сахара (ацетата свинца(II)). Установить состав этого вещества удалось только в 1852 году Александру Уильяму Уильямсону[3].
Физические свойства
Кетоны — летучие жидкости или легкоплавкие твёрдые вещества, низшие представители хорошо растворимы в воде и смешиваются с органическими растворителями, некоторые (ацетон) смешиваются с водой в любых соотношениях. Невозможность образования межмолекулярных водородных связей обуславливает несколько бо́льшую их летучесть, чем у спиртов и карбоновых кислот с той же молекулярной массой (например, ацетон кипит при 56,1 °C, а пропанол-2 — при 82,4 °C).
Методы синтеза
- Циклокетоны можно получить циклизацией Ружички.
- Гидратация гомологов ацетилена (реакция Кучерова).
- Кетоны с хорошими выходами получаются при взаимодействии хлорангидридов кислот с диалкилкупратами лития и алкилкадмиевыми соединениями:
- R2CuLi+R′COCl→RC(O)R′+LiCl+CuR{\displaystyle {\mathsf {R_{2}CuLi+R’COCl\rightarrow RC(O)R’+LiCl+CuR}}}
- 2RCOCl+Cd(C2H5)2→2RC(O)C2H5+CdCl2{\displaystyle {\mathsf {2RCOCl+Cd(C_{2}H_{5})_{2}\rightarrow 2RC(O)C_{2}H_{5}+CdCl_{2}}}}
Химические свойства
Кето-енольная таутомерия
Кето-енольная таутомеризация. 1 – кето-форма; 2 – енольная форма.Кетоны, которые имеют по крайней мере один альфа-водородный атом, подвергаются кето-енольной таутомеризации. Таутомеризация катализируется как кислотами, так и основаниями. Как правило, кето-форма является более стабильной, чем енольная. Это равновесие позволяет получать кетоны путём гидратации алкинов. Относительная стабилизация енольной формы сопряжением является причиной довольно сильной кислотности кетонов (pKa ≈ 20) в сравнении с алканами (pKa ≈ 50).
Гидрирование
Присоединение водорода к кетонам происходит в присутствии катализаторов гидрирования (Ni, Co, Cu, Pt, Pd и др.). В последнее время в качестве гидрирующего агента часто используют алюмогидрид лития. При этом кетоны превращаются во вторичные спирты:
- R2CO+2H→R2CH(OH){\displaystyle {\mathsf {R_{2}CO+2H\rightarrow R_{2}CH(OH)}}}
При восстановлении кетонов водородом в момент выделения (с помощью щелочных металлов или амальгамы магния) образуются также гликоли (пинаконы):
- 2R2CO+2H→R2C(OH)−CR2(OH){\displaystyle {\mathsf {2R_{2}CO+2H\rightarrow R_{2}C(OH){-}CR_{2}(OH)}}}
Реакции нуклеофильного присоединения
- (Ch4)2CO+HCN→(Ch4)2C(OH)CN{\displaystyle {\mathsf {(CH_{3})_{2}CO+HCN\rightarrow (CH_{3})_{2}C(OH)CN}}}
- (Ch4)2C(OH)CN+2h3O→(Ch4)2C(OH)COOH+Nh4{\displaystyle {\mathsf {(CH_{3})_{2}C(OH)CN+2H_{2}O\rightarrow (CH_{3})_{2}C(OH)COOH+NH_{3}}}}
- (Ch4)2CO→OH−(Ch4)2C=CH−C(O)−Ch4→+Nh4(Ch4)2C(Nh3)Ch3−C(O)−Ch4{\displaystyle {\mathsf {(CH_{3})_{2}CO{\xrightarrow[{OH-}]{}}(CH_{3})_{2}C{=}CH{-}C(O){-}CH_{3}{\xrightarrow[{+NH_{3}}]{}}(CH_{3})_{2}C(NH_{2})CH_{2}{-}C(O){-}CH_{3}}}}
- Присоединение гидросульфита натрия даёт гидросульфитные (бисульфитные) производные (в реакцию в жирном ряду вступают лишь метилкетоны):
- RC(O)Ch4+HSO3Na→R−C(OH)(SO3Na)−Ch4{\displaystyle {\mathsf {RC(O)CH_{3}+HSO_{3}Na\rightarrow R{-}C(OH)(SO_{3}Na){-}CH_{3}}}}
При нагревании с раствором соды или минеральной кислотой гидросульфитные производные разлагаются с выделением свободного кетона:
- 2R−C(OH)(SO3Na)−Ch4+Na2CO3→2RC(O)Ch4+2Na2SO3+CO2+h3O{\displaystyle {\mathsf {2R{-}C(OH)(SO_{3}Na){-}CH_{3}+Na_{2}CO_{3}\rightarrow 2RC(O)CH_{3}+2Na_{2}SO_{3}+CO_{2}+H_{2}O}}}
- (Ch4)2CO+Nh3OH→h3O+(Ch4)2C=N−OH{\displaystyle {\mathsf {(CH_{3})_{2}CO+NH_{2}OH\rightarrow H_{2}O+(CH_{3})_{2}C{=}N{-}OH}}}
- (Ch4)2CO+N2h5→(Ch4)2C=N−Nh3+h3O{\displaystyle {\mathsf {(CH_{3})_{2}CO+N_{2}H_{4}\rightarrow (CH_{3})_{2}C{=}N{-}NH_{2}+H_{2}O}}}
- 2(Ch4)2CO+N2h5→(Ch4)2−C=N−N=C−(Ch4)2+2h3O{\displaystyle {\mathsf {2(CH_{3})_{2}CO+N_{2}H_{4}\rightarrow (CH_{3})_{2}-C{=}N{-}N{=}C-(CH_{3})_{2}+2H_{2}O}}}
Как и в случае альдегидов, при нагревании с твёрдым KOH гидразоны кетонов выделяют азот и дают предельные углеводороды (реакция Кижнера)
- Ацетали кетонов получаются сложнее, чем ацетали альдегидов, — действием на кетоны эфиров ортомуравьиной HC(OC2H5)3 или ортокремниевой кислоты.
Реакции конденсации
В жёстких условиях (в присутствии щелочей) кетоны подвергаются альдольной конденсации. При этом образуются β-кетоспирты, легко теряющие молекулу воды.
В ещё более жестких условиях, например при нагревании с концентрированной серной кислотой, кетоны подвергаются межмолекулярной дегидратации с образованием непредельных кетонов:
- 2(Ch4)2CO→h3O+(Ch4)2C=CH−C(O)−Ch4{\displaystyle {\mathsf {2(CH_{3})_{2}CO\rightarrow H_{2}O+(CH_{3})_{2}C{=}CH{-}C(O){-}CH_{3}}}}
Окись мезитила может реагировать с новой молекулой ацетона с образованием форона:
- (Ch4)2C=CH−C(O)−Ch4+(Ch4)2CO→(Ch4)2C=CH−C(O)−CH=C(Ch4)2{\displaystyle {\mathsf {(CH_{3})_{2}C{=}CH{-}C(O){-}CH_{3}+(CH_{3})_{2}CO\rightarrow (CH_{3})_{2}C{=}CH{-}C(O){-}CH{=}C(CH_{3})_{2}}}}
К отдельному типу реакций можно отнести восстановление кетонов — реакция Лейкарта — Валлаха.
Важнейшие кетоны
Биохимия
Токсичны. Обладают раздражающим и местным действием, проникают через кожу, особенно хорошо ненасыщенные алифатические. Отдельные вещества обладают канцерогенным и мутагенным эффектом. Галогенпроизводные кетонов вызывают сильное раздражение слизистых оболочек и ожоги при контакте с кожей. Алициклические кетоны обладают наркотическим действием.
Кетоны играют важную роль в метаболизме веществ в живых организмах. Так, убихинон участвует в окислительно-восстановительных реакциях тканевого дыхания. К соединениям, содержащим кетонную группу, относятся некоторые важные моносахариды (фруктоза и др.), терпены (ментон, карвон), компоненты эфирных масел (камфора, жасмон), природные красители (индиго, ализарин, флавоны), стероидные гормоны (кортизон, прогестерон), мускус (мускон), антибиотик тетрациклин.
В процессе фотосинтеза 1,5-дифосфат-D-эритро-пентулозы (фосфолированная кетопентоза) является катализатором. Ацетоуксусная кислота — промежуточный продукт в цикле Кребса.
Наличие в моче и крови человека кетонов говорит о гипергликемии, различных расстройствах метаболизма или кетоацидозе.
Применение
В промышленности кетоны используют как растворители, фармацевтические препараты и для изготовления различных полимеров. Важнейшими кетонами являются ацетон, метилэтиловый кетон и циклогексанон[5].
См. также
Примечания
Литература
- Общая токсикология / под ред. А. О. Лойта. Спб.: ЭЛБИ-СПб., 2006
- Химическая Энциклопедия в 5 томах ред. И. Л. Кнунянц 2 том
Тема №23 «Характерные химические свойства: альдегидов, кетонов и предельных карбоновых кислот»
- НОВОСТИ
- КУРС ХИМИИ
- Дополнительные уроки
- Курс химии
- Разбор заданий ЕГЭ
- ТЕСТЫ
- Вариаты ЕГЭ
- Тесты по заданиям
- Тесты по темам
- СТАТЬИ
- ОПЫТЫ
- ТАБЛИЦА МЕНДЕЛЕЕВА
Поиск
 CHEM-MIND.com
CHEM-MIND.com


- НОВОСТИ
-
 Новости
НовостиАлгоритм обучения для подготовки к ЕГЭ по химии
 Новости
НовостиОтветы в тестах вновь правильно отображаются!
 Новости
НовостиТехнические проблемы
 Новости
НовостиНовый раздел на сайте
 Новости
НовостиС 8 марта
-
- КУРС ХИМИИ
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ
 Разбор заданий ЕГЭ
Разбор заданий ЕГЭРазбор задания №11 ЕГЭ по химии
 Разбор заданий ЕГЭ
Разбор заданий ЕГЭРазбор задания №10 ЕГЭ по химии
 Разбор заданий ЕГЭ
Разбор заданий ЕГЭРазбор задания №9 ЕГЭ по химии
 Разбор заданий ЕГЭ
Разбор заданий ЕГЭРазбор задания №8 ЕГЭ по химии
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ
- ТЕСТЫ
- ВсеВариаты ЕГЭТесты по заданиямТесты по темам
 Тесты по темам
Тесты по темамТест №40 «Высокомолекулярные соединения»
 Тесты по темам
Тесты по темамТест №39 «Химия и проблемы охраны окружающей среды»
 Тесты по темам
Тесты по темамТест №38 «Общие научные принципы химического производства»
 Тесты по темам
Тесты по темамТест №37 «Химическая лаборатория»
- ВсеВариаты ЕГЭТесты по заданиямТесты по темам
- СТАТЬИ
-
 Статьи
СтатьиРешение типовых задач по химии
-
АЛЬДЕГИДЫ И КЕТОНЫ | Энциклопедия Кругосвет
Содержание статьиАЛЬДЕГИДЫ И КЕТОНЫ – органические соединения, содержащие фрагмент >C=O (углерод, связанный двойной связью с кислородом, его называют карбонильным). У альдегидов карбонильный углерод соединен с атомом Н и органической группой R (общая формула RHC=O), а в кетонах – с двумя органическими группами (общая формула R2С=О).
Номенклатура альдегидов и кетонов. Группу –(Н)С=О называют альдегидной, для связывания с органическими группами у нее есть всего одна свободная валентность, это позволяет ей находится только на конце углеводородной цепи (но не в середине). При составлении названия альдегида указывается название соответствующего углеводорода, к которому добавляется суффикс «аль», например, метаналь Н2С=О, этаналь Н3СС(Н)=О, пропаналь Н3ССН2С(Н)=О. В более сложных случаях углеродную цепь группы R нумеруют, начиная с карбонильного углерода, затем с помощью числовых индексов указывают положение функциональных групп и различных заместителей.
Рис. 1. НОМЕНКЛАТУРА АЛЬДЕГИДОВ. Замещающие и функциональные группы, а также соответствующие им цифровые индексы выделены различающимися цветами.
Для некоторых альдегидов часто используют тривиальные (упрощенные) названия, сложившиеся исторически, например, формальдегид Н2С=О, ацетальдегид Н3СС(Н)=О, кротоновый альдегид СН3СН=CHC(H)=O.
В отличие от альдегидной, кетонная группа >C=O может находиться также в середине углеводородной цепи, поэтому в простых случаях указывают названия органических групп (упоминая их в порядке увеличения) и добавляют слово «кетон»: диметилкетон CH3–CO–CH3, метилэтилкетон CH3CH2–CO–CH3. В более сложных случаях положение кетонной группы в углеводородной цепи указывают цифровым индексом, добавляя суффикс «он». Нумерацию углеводородной цепи начинают с того конца, который находится ближе к кетонной группе (рис. 2).

Рис. 2. НОМЕНКЛАТУРА КЕТОНОВ. Замещающие и функциональные группы и соответствующие им цифровые индексы выделены различными цветами.
Для простейшего кетона CH3–CO–CH3 принято тривиальное название – ацетон.
Химические свойства альдегидов и кетонов
определяются особенностями карбонильной группы >C=O, обладающей полярностью – электронная плотность между атомами С и О распределена неравномерно, сдвинута к более электроотрицательному атому О. В результате карбонильная группа приобретает повышенную реакционную способность, что проявляется в разнообразных реакциях присоединения по двойной связи. Во всех случаях кетоны менее реакционноспособны, чем альдегиды, в частности, из-за пространственных затруднений, создаваемых двумя органическими группами R, наиболее легко участвует в реакциях формальдегид Н2С=О.
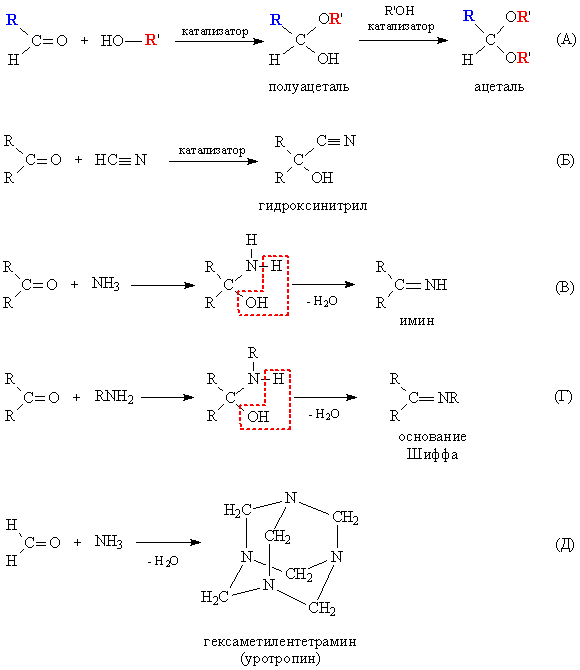
1. Присоединение по двойной связи С=О.
При взаимодействии со спиртами альдегиды образуют полуацетали – соединения, содержащие одновременно алкокси- и гидрокси-группу у одного атома углерода: >C(OH)OR. Полуацетали могут далее реагировать с еще одной молекулой спирта, образуя полные ацетали – соединения, где у одного атома углерода находятся одновременно две RО-группы: >C(OR)2. Реакцию катализируют кислоты и основания (рис. 3А). В случае кетонов присоединение спиртов к двойной связи в С=О затруднено.
Сходным образом альдегиды и кетоны реагируют с синильной кислотой HCN, образуя гидроксинитрилы – соединения, содержащие у одного атома углерода ОН- и CN-группу: >C(OH)CєN (рис. 3Б). Реакция примечательна тем, что позволяет увеличивать углеродную цепь (возникает новая связь С-С).
Точно так же (раскрывая двойную связь С=О) аммиак и амины реагируют с альдегидами и кетонами, продукты присоединения неустойчивы и конденсируются с выделением воды и образованием двойной связи C=N. В случае аммиака получаются имины (рис. 3В), а из аминов образуются так называемые основания Шиффа – соединения, содержащие фрагмент >C=NR (рис. 3Г). Продукт взаимодействия формальдегида с аммиаком несколько иной – это результат циклизации трех промежуточных молекул, в результате получается каркасное соединение гексаметилентетрамин, используемое в медицине как препарат уротропин (рис. 3Д).
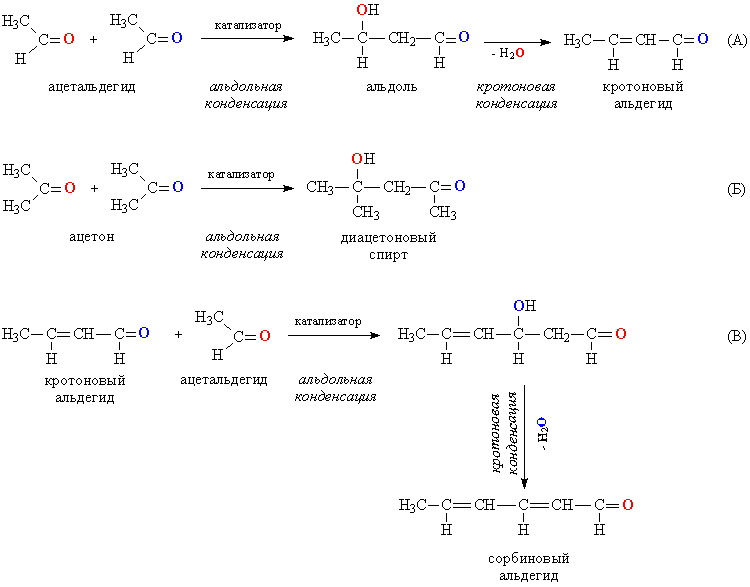
2. Реакции конденсации. Для альдегидов и кетонов возможна конденсация, проходящая между двумя молекулами одного и того же соединения. При такой конденсации альдегидов двойная связь одной из молекул раскрывается, образуется соединение, содержащее одновременно альдегидную и ОН-группу, называемое альдолем (альдегидоспирт). Протекающую конденсацию называют, соответственно, альдольной, эту реакцию катализируют основания (рис. 4А). Полученный альдоль может далее конденсироваться с образованием двойной связи С=С и выделением конденсационной воды. В итоге получается ненасыщенный альдегид (рис. 4А, кротоновой альдегид). Такую конденсацию называют кротоновой по названию первого соединения в ряду ненасыщенных альдегидов. Кетоны также способны участвовать в альдольной конденсации (рис. 4Б), а вторая стадия – кротоновая конденсация, для них затруднена. В альдольной конденсации могут совместно участвовать молекулы различных альдегидов, а также одновременно альдегид и кетон, во всех случаях происходит удлинение углеродной цепи. Получившийся на последней стадии (рис. 4А) кротоновый альдегид, обладая всеми свойствами альдегидов, может далее участвовать в альдольной и кротоновой конденсации при взаимодействии с очередной порцией ацетальдегида, из которого он и был получен (рис. 4В). Таким способом можно удлинять углеводородную цепь, получая соединения, в которых чередуются простые и двойные связи: –СН=СН–СН=СН–.
Конденсация альдегидов и кетонов с фенолами идет с удалением карбонильного атома О (в виде воды), а метиленовая группа СН2 или замещенная метиленовая группа (СНR либо СR2) встраивается между двумя молекулами фенола. Наиболее широко эту реакцию применяют для получения фенолоформальдегидных смол (рис. 5.).
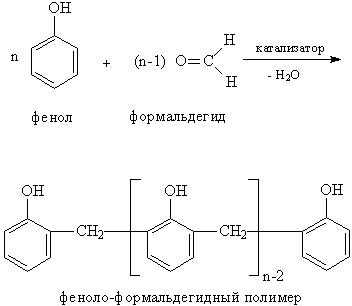
Рис. 5. КОНДЕНСАЦИЯ ФЕНОЛА С ФОРМАЛЬДЕГИДОМ
3. Полимеризация карбонильных соединений протекает с раскрытием двойной связи С=О и свойственна, в основном, альдегидам. При упаривании в вакууме водных растворов формальдегида образуется смесь циклических соединений (в основном, триоксиметилен) и линейных продуктов с незначительной длиной цепи n = 8–12 (параформ). Полимеризацией циклического продукта получают полиформальдегид (рис. 6) – полимер с высокой прочностью и хорошими электроизоляционными свойствами, используемый как конструкционный материал в машино- и приборостроении.
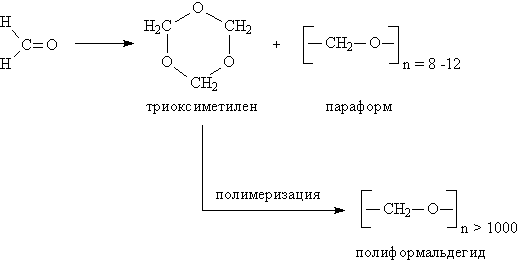
Рис. 6. ПРОДУКТЫ ПОЛИМЕРИЗАЦИИ ФОРМАЛЬДЕГИДА
4. Восстановление и окисление. Альдегиды и кетоны представляют собой как бы промежуточные соединения между спиртами и карбоновыми кислотами: восстановление приводит к спиртам, а окисление –- к карбоновым кислотам. При действии Н2 (в присутствии катализатора Pt или Ni) либо других восстанавливающих реагентов, например, LiAlH4, альдегиды восстанавливаются, образуя первичные спирты, а кетоны – вторичные спирты (рис. 7, схемы А и Б).
Окисление альдегидов до карбоновых кислот проходит достаточно легко в присутствии О2 или при действии слабых окислителей, таких как аммиачный раствор гидроксида серебра (рис. 7В). Эта эффектная реакция сопровождается образованием серебряного зеркала на внутренней поверхности реакционного прибора (чаще, обычной пробирки), ее используют для качественного обнаружения альдегидной группы. В отличие от альдегидов, кетоны более устойчивы к окислению, при их нагревании в присутствии сильных окислителей, например, КМnО4, образуются смеси карбоновых кислот, имеющих укороченную (в сравнении с исходным кетоном) углеводородную цепь.
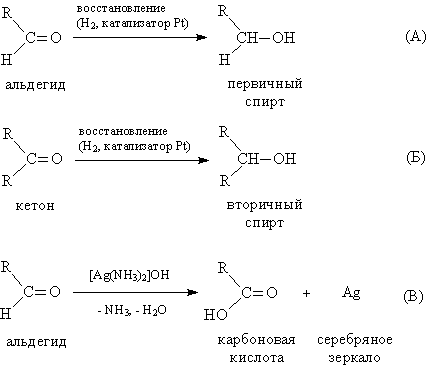
Рис. 7. ВОССТАНОВЛЕНИЕ И ОКИСЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ
Дополнительным подтверждением того, что альдегиды занимают промежуточное положение между спиртами и кислотами, служит реакция, в результате которой из двух молекул альдегида получаются спирт и карбоновая кислота (рис. 8А), т.е. одна молекула альдегида окисляется, а другая восстанавливается. В некоторых случаях два полученных соединения – спирт и карбоновая кислота – далее реагируют между собой, образуя сложный эфир (рис.8Б).

Рис. 8. ПРОТЕКАЮЩЕЕ ОДНОВРЕМЕННО ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ АЛЬДЕГИДОВ
Получение альдегидов и кетонов.
Наиболее универсальный способ – окисление спиртов, при этом из первичных спиртов образуются альдегиды, а из вторичных – кетоны (рис. 9А и Б). Это реакции, обратные реакциям на рис. 7А и Б. Реакция поворачивает «вспять», если изменен действующий реагент (окислитель вместо восстановителя) и катализатор, при окислении спиртов эффективен медный катализатор.
В промышленности ацетальдегид получают окислением этилена (рис. 9В), на промежуточной стадии образуется спирт, у которого ОН-группа «примыкает» к двойной связи (виниловый спирт), такие спирты неустойчивы и сразу изомеризуются в карбонильные соединения. Другой способ – каталитическая гидратация ацетилена (рис. 9Г), промежуточное соединение – виниловый спирт. Если вместо ацетилена взять метилацетилен, то получится ацетон (рис. 9Д). Промышленный способ получения ацетона – окислением кумола. Ароматические кетоны, например, ацетофенон, получают каталитическим присоединением ацетильной группы к ароматическому ядру (рис. 9Е).
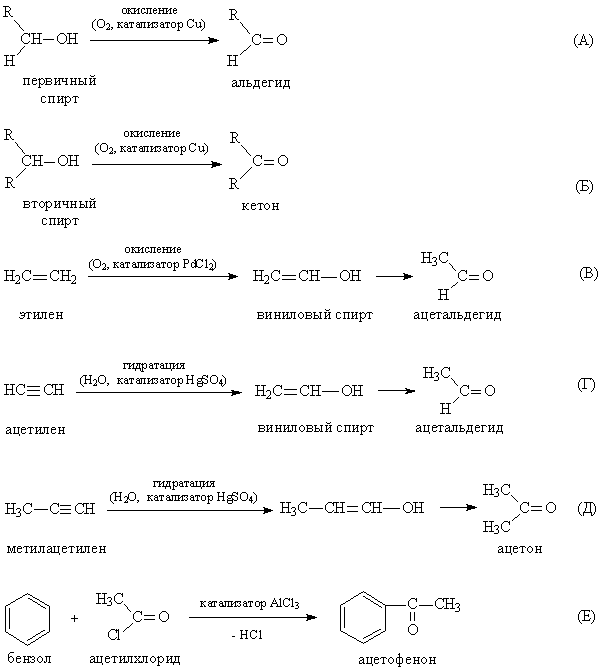
Применение альдегидов и кетонов.
Формальдегид Н2С=О (его водный раствор называют формалином) используют как дубитель кожи и консервант биологических препаратов.
Ацетон (СН3)2С=О – широко применяемый экстрагент и растворитель лаков и эмалей.
Ароматический кетон бензофенон (С6Н5)2С=О с запахом герани, используется в парфюмерных композициях и для ароматизации мыла.
Некоторые из альдегидов были сначала найдены в составе эфирных масел растений, а позже искусственно синтезированы.
Алифатический альдегид СН3(СН2)7С(Н)=О (тривиальное название – пеларгоновый альдегид) содержится в эфирных маслах цитрусовых растений, обладает запахом апельсина, его используют как пищевой ароматизатор.
Ароматический альдегид ванилин (рис. 10) содержится в плодах тропического растения ванили, сейчас чаще используется синтетический ванилин – широко известная ароматизирующая добавка в кондитерские изделия (рис. 10).
Рис. 10. ВАНИЛИН
Бензальдегид С6Н5С(Н)=О с запахом горького миндаля содержится в миндальном масле и в эфирном масле эвкалипта. Синтетический бензальдегид используется в пищевых ароматических эссенциях и в парфюмерных композициях.
Бензофенон (С6Н5)2С=О и его производные способны поглощать УФ-лучи, что определило их применение в кремах и лосьонах от загара, кроме того, некоторые производные бензофенона обладают противомикробной активностью и применяются в качестве консервантов. Бензофенон обладает приятным запахом герани, и потому его используют в парфюмерных композициях и для ароматизации мыла.
Способность альдегидов и кетонов участвовать в различных превращениях определила их основное применение в качестве исходных соединений для синтеза разнообразных органических веществ: спиртов, карбоновых кислот и их ангидридов, лекарственных препаратов (уротропин), полимерных продуктов (фенолоформальдегидные смолы, полиформальдегид), в производстве всевозможных душистых веществ (на основе бензальдегида) и красителей.
Михаил Левицкий
Кетоны — Википедия
Кето́ны — органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
Общая формула кетонов: R1-CO-R2.
Среди других карбонильных соединений наличие в кетонах именно двух атомов углерода, непосредственно связанных с карбонильной группой, отличает их от карбоновых кислот и их производных, а также альдегидов.
Этимология
Слово кетон произошло от старого немецкого слова Aketon (ацетон). Придумал его в 1848 году немецкий химик Леопольд Гмелин (1788—1853)[1].
Номенклатура
Названия алифатических и алициклических кетонов образуют, прибавляя суффикс -он или -дион (для дикетонов) к названию родоночального углеводорода. Дикетоны ароматического ряда с кетонными группами в ядре называют сокращённым названием углеводорода, добавляя суффикс -хинон[2].
Другие номенклатуры
Тривиальная номенклатура. Для простейших кетонов используются их тривиальные названия, например, ацетон (для 2-пропанона) и бензофенон (для дифенилкетона).
Радикало-функциональная номенклатура. Допускается название кетонов по радикально-функциональной номенклатуре, при этом название составляется из радикалов при кетогруппе (в алфавитном порядке) и названия класса соединений (функции) —кетон (например, метилэтилкетон — CH3-CO-CH2-CH3).
История открытия кетонов
Ацетон был открыт Робертом Бойлем в 1661 году при нагревании ацетата кальция (ацетон происходит от лат. acetum — уксус):
- Ca(Ch4COO)2→t(Ch4)2CO+CaCO3{\displaystyle {\mathsf {Ca(CH_{3}COO)_{2}{\xrightarrow {t}}{}(CH_{3})_{2}CO+CaCO_{3}}}}
Похожая реакция была описана Андреасом Либавием — ацетон образовывался при нагревании свинцового сахара (ацетата свинца(II)). Установить состав этого вещества удалось только в 1852 году Александру Уильяму Уильямсону[3].
Физические свойства
Кетоны — летучие жидкости или легкоплавкие твёрдые вещества, низшие представители хорошо растворимы в воде и смешиваются с органическими растворителями, некоторые (ацетон) смешиваются с водой в любых соотношениях. Невозможность образования межмолекулярных водородных связей обуславливает несколько бо́льшую их летучесть, чем у спиртов и карбоновых кислот с той же молекулярной массой (например, ацетон кипит при 56,1 °C, а пропанол-2 — при 82,4 °C).
Методы синтеза
- Циклокетоны можно получить циклизацией Ружички.
- Гидратация гомологов ацетилена (реакция Кучерова).
- Кетоны с хорошими выходами получаются при взаимодействии хлорангидридов кислот с диалкилкупратами лития и алкилкадмиевыми соединениями:
- R2CuLi+R′COCl→RC(O)R′+LiCl+CuR{\displaystyle {\mathsf {R_{2}CuLi+R’COCl\rightarrow RC(O)R’+LiCl+CuR}}}
- 2RCOCl+Cd(C2H5)2→2RC(O)C2H5+CdCl2{\displaystyle {\mathsf {2RCOCl+Cd(C_{2}H_{5})_{2}\rightarrow 2RC(O)C_{2}H_{5}+CdCl_{2}}}}
Химические свойства
Кето-енольная таутомерия
Кето-енольная таутомеризация. 1 – кето-форма; 2 – енольная форма.Кетоны, которые имеют по крайней мере один альфа-водородный атом, подвергаются кето-енольной таутомеризации. Таутомеризация катализируется как кислотами, так и основаниями. Как правило, кето-форма является более стабильной, чем енольная. Это равновесие позволяет получать кетоны путём гидратации алкинов. Относительная стабилизация енольной формы сопряжением является причиной довольно сильной кислотности кетонов (pKa ≈ 20) в сравнении с алканами (pKa ≈ 50).
Гидрирование
Присоединение водорода к кетонам происходит в присутствии катализаторов гидрирования (Ni, Co, Cu, Pt, Pd и др.). В последнее время в качестве гидрирующего агента часто используют алюмогидрид лития. При этом кетоны превращаются во вторичные спирты:
- R2CO+2H→R2CH(OH){\displaystyle {\mathsf {R_{2}CO+2H\rightarrow R_{2}CH(OH)}}}
При восстановлении кетонов водородом в момент выделения (с помощью щелочных металлов или амальгамы магния) образуются также гликоли (пинаконы):
- 2R2CO+2H→R2C(OH)−CR2(OH){\displaystyle {\mathsf {2R_{2}CO+2H\rightarrow R_{2}C(OH){-}CR_{2}(OH)}}}
Реакции нуклеофильного присоединения
- (Ch4)2CO+HCN→(Ch4)2C(OH)CN{\displaystyle {\mathsf {(CH_{3})_{2}CO+HCN\rightarrow (CH_{3})_{2}C(OH)CN}}}
- (Ch4)2C(OH)CN+2h3O→(Ch4)2C(OH)COOH+Nh4{\displaystyle {\mathsf {(CH_{3})_{2}C(OH)CN+2H_{2}O\rightarrow (CH_{3})_{2}C(OH)COOH+NH_{3}}}}
- (Ch4)2CO→OH−(Ch4)2C=CH−C(O)−Ch4→+Nh4(Ch4)2C(Nh3)Ch3−C(O)−Ch4{\displaystyle {\mathsf {(CH_{3})_{2}CO{\xrightarrow[{OH-}]{}}(CH_{3})_{2}C{=}CH{-}C(O){-}CH_{3}{\xrightarrow[{+NH_{3}}]{}}(CH_{3})_{2}C(NH_{2})CH_{2}{-}C(O){-}CH_{3}}}}
- Присоединение гидросульфита натрия даёт гидросульфитные (бисульфитные) производные (в реакцию в жирном ряду вступают лишь метилкетоны):
- RC(O)Ch4+HSO3Na→R−C(OH)(SO3Na)−Ch4{\displaystyle {\mathsf {RC(O)CH_{3}+HSO_{3}Na\rightarrow R{-}C(OH)(SO_{3}Na){-}CH_{3}}}}
При нагревании с раствором соды или минеральной кислотой гидросульфитные производные разлагаются с выделением свободного кетона:
- 2R−C(OH)(SO3Na)−Ch4+Na2CO3→2RC(O)Ch4+2Na2SO3+CO2+h3O{\displaystyle {\mathsf {2R{-}C(OH)(SO_{3}Na){-}CH_{3}+Na_{2}CO_{3}\rightarrow 2RC(O)CH_{3}+2Na_{2}SO_{3}+CO_{2}+H_{2}O}}}
- (Ch4)2CO+Nh3OH→h3O+(Ch4)2C=N−OH{\displaystyle {\mathsf {(CH_{3})_{2}CO+NH_{2}OH\rightarrow H_{2}O+(CH_{3})_{2}C{=}N{-}OH}}}
- (Ch4)2CO+N2h5→(Ch4)2C=N−Nh3+h3O{\displaystyle {\mathsf {(CH_{3})_{2}CO+N_{2}H_{4}\rightarrow (CH_{3})_{2}C{=}N{-}NH_{2}+H_{2}O}}}
- 2(Ch4)2CO+N2h5→(Ch4)2−C=N−N=C−(Ch4)2+2h3O{\displaystyle {\mathsf {2(CH_{3})_{2}CO+N_{2}H_{4}\rightarrow (CH_{3})_{2}-C{=}N{-}N{=}C-(CH_{3})_{2}+2H_{2}O}}}
Как и в случае альдегидов, при нагревании с твёрдым KOH гидразоны кетонов выделяют азот и дают предельные углеводороды (реакция Кижнера)
- Ацетали кетонов получаются сложнее, чем ацетали альдегидов, — действием на кетоны эфиров ортомуравьиной HC(OC2H5)3 или ортокремниевой кислоты.
Реакции конденсации
В жёстких условиях (в присутствии щелочей) кетоны подвергаются альдольной конденсации. При этом образуются β-кетоспирты, легко теряющие молекулу воды.
В ещё более жестких условиях, например при нагревании с концентрированной серной кислотой, кетоны подвергаются межмолекулярной дегидратации с образованием непредельных кетонов:
- 2(Ch4)2CO→h3O+(Ch4)2C=CH−C(O)−Ch4{\displaystyle {\mathsf {2(CH_{3})_{2}CO\rightarrow H_{2}O+(CH_{3})_{2}C{=}CH{-}C(O){-}CH_{3}}}}
Окись мезитила может реагировать с новой молекулой ацетона с образованием форона:
- (Ch4)2C=CH−C(O)−Ch4+(Ch4)2CO→(Ch4)2C=CH−C(O)−CH=C(Ch4)2{\displaystyle {\mathsf {(CH_{3})_{2}C{=}CH{-}C(O){-}CH_{3}+(CH_{3})_{2}CO\rightarrow (CH_{3})_{2}C{=}CH{-}C(O){-}CH{=}C(CH_{3})_{2}}}}
К отдельному типу реакций можно отнести восстановление кетонов — реакция Лейкарта — Валлаха.
Важнейшие кетоны
Биохимия
Токсичны. Обладают раздражающим и местным действием, проникают через кожу, особенно хорошо ненасыщенные алифатические. Отдельные вещества обладают канцерогенным и мутагенным эффектом. Галогенпроизводные кетонов вызывают сильное раздражение слизистых оболочек и ожоги при контакте с кожей. Алициклические кетоны обладают наркотическим действием.
Кетоны играют важную роль в метаболизме веществ в живых организмах. Так, убихинон участвует в окислительно-восстановительных реакциях тканевого дыхания. К соединениям, содержащим кетонную группу, относятся некоторые важные моносахариды (фруктоза и др.), терпены (ментон, карвон), компоненты эфирных масел (камфора, жасмон), природные красители (индиго, ализарин, флавоны), стероидные гормоны (кортизон, прогестерон), мускус (мускон), антибиотик тетрациклин.
В процессе фотосинтеза 1,5-дифосфат-D-эритро-пентулозы (фосфолированная кетопентоза) является катализатором. Ацетоуксусная кислота — промежуточный продукт в цикле Кребса.
Наличие в моче и крови человека кетонов говорит о гипергликемии, различных расстройствах метаболизма или кетоацидозе.
Применение
В промышленности кетоны используют как растворители, фармацевтические препараты и для изготовления различных полимеров. Важнейшими кетонами являются ацетон, метилэтиловый кетон и циклогексанон[5].
См. также
Примечания
Литература
- Общая токсикология / под ред. А. О. Лойта. Спб.: ЭЛБИ-СПб., 2006
- Химическая Энциклопедия в 5 томах ред. И. Л. Кнунянц 2 том

 Новости
Новости Новости
Новости Новости
Новости Новости
Новости Новости
Новости Разбор заданий ЕГЭ
Разбор заданий ЕГЭ Разбор заданий ЕГЭ
Разбор заданий ЕГЭ Разбор заданий ЕГЭ
Разбор заданий ЕГЭ Разбор заданий ЕГЭ
Разбор заданий ЕГЭ Тесты по темам
Тесты по темам Тесты по темам
Тесты по темам Тесты по темам
Тесты по темам Тесты по темам
Тесты по темам Статьи
Статьи