Лимонная кислота: польза и вред для организма
Тем не менее эта синтезированная форма отличается от лимонной кислоты, содержащейся в цитрусовых фруктах.
По этой причине вы можете задаться вопросом, полезна ли лимонная кислота или же вредна для вашего здоровья.
В этой статье объясняются различия между натуральной и синтетической лимонной кислотой, а также рассматриваются ее полезные свойства, применение и безопасность.

Лимонная кислота – польза и вред для здоровья женщины и мужчины
Что такое лимонная кислота?
Лимонная кислота была впервые получена из лимонного сока шведским исследователем в 1784 году (1).
Это вещество без запаха и цвета производилось из лимонного сока до начала 1900-х годов, когда исследователи обнаружили, что его также можно изготавливать из черной плесени (Aspergillus niger), которая создает лимонную кислоту, когда питается сахаром (1, 2).
Из-за своей кислой природы лимонная кислота преимущественно используется в качестве ароматизатора и консерванта, особенно в безалкогольных напитках и конфетах.
Она также используется для стабилизации или сохранения лекарств и в качестве дезинфицирующего средства против вирусов и бактерий.
Резюме:
Лимонная кислота – это вещество, первоначально полученное из лимонного сока. Сегодня ее изготавливают из определенного типа плесени и применяют в самых разных областях.
В каких продуктах содержится лимонная кислота
Цитрусовые и их соки являются лучшими природными источниками лимонной кислоты (3).
На самом деле слово «лимонный» происходит от латинского слова «citrus
Вот распространенные примеры цитрусовых фруктов:
Другие фрукты, ягоды и овощи также содержат лимонную кислоту, но в меньших количествах. К ним относятся:
- ананас
- клубника
- малина
- клюква
- вишня
- помидоры
Напитки или пищевые продукты, которые содержат эти фрукты – такие, как кетчуп в случае помидоров – также содержат лимонную кислоту.
Лимонная кислота также является побочным продуктом производства сыра, вина и закваски.
Лимонную кислоту, указанную в ингредиентах продуктов питания и пищевых добавок, получают не из цитрусовых фруктов (4).
Это связано с тем, что производство этой добавки из цитрусовых слишком дорого, а спрос намного превышает предложение.
Резюме:
Лимоны, лаймы и другие цитрусовые фрукты являются преобладающими природными источниками лимонной кислоты. К другим фруктам и овощам, которые содержат гораздо меньшее ее количество, относятся определенные ягоды, вишни и помидоры.
Искусственные источники и применение
Характеристики лимонной кислоты делают ее важной добавкой для различных отраслей промышленности.
В еде и напитках используется около 70% произведенной лимонной кислоты, в фармацевтических и диетических добавках – 20%, а оставшиеся 10% идут на чистящие средства (4).
Пищевая промышленность
Произведенная лимонная кислота является одной из самых распространенных пищевых добавок в мире.
Она используется для повышения кислотности, улучшения вкуса и сохранения ингредиентов (5).
Газированные напитки, соки, порошкообразные напитки, конфеты, замороженные продукты и некоторые молочные продукты часто содержат промышленную лимонную кислоту.
Ее также добавляют в консервированные фрукты и овощи для защиты от ботулизма – редкого, но серьезного заболевания, вызываемого производящими токсин бактериями Clostridium botulinum.
Лекарства и пищевые добавки
Лимонная кислота является основным продуктом в медицине и пищевых добавках.
Она добавляется в лекарства для стабилизации и сохранения активных ингредиентов и используется для усиления или маскировки вкуса жевательных препаратов и препаратов на основе сиропа (6).
Добавки минералов, таких как магний и кальций, могут содержать лимонную кислоту – в форме цитрата – так как это улучшает их усвоение.
Дезинфекция и очистка
Лимонная кислота является полезным дезинфицирующим средством против различных бактерий и вирусов (7, 8, 9).
Исследование в пробирке показало, что она может быть эффективной в лечении или профилактике норовирусной инфекции человека – основной причины болезней пищевого происхождения (10).
Лимонная кислота продается в качестве дезинфицирующего и чистящего средства для удаления накипи, пятен жесткой воды, извести и ржавчины.
Она рассматривается как более безопасная альтернатива обычным дезинфицирующим и чистящим средствам, таким как кват и хлорный отбеливатель (1).
Резюме:
Лимонная кислота является универсальной добавкой для пищевых продуктов, напитков, лекарств и пищевых добавок, а также для чистящих и дезинфицирующих средств.
Польза для здоровья
Лимонная кислота обладает многочисленными полезными свойствами.
Метаболизирует энергию
Цитрат – соль лимонной кислоты – это первая молекула, которая образуется в процессе, называемом циклом лимонной кислоты.
Эти химические реакции в вашем организме, также известные как цикл трикарбоновых кислот (ЦТК) или цикл Кребса, помогают преобразовать пищу в полезную энергию (11).
Люди и другие организмы получают большую часть своей энергии из этого цикла.
Улучшает усвоение питательных веществ
Добавки минералов доступны в различных формах.
Но не все формы созданы равными, поскольку ваш организм использует некоторые более эффективно.
Лимонная кислота повышает биодоступность минералов, позволяя вашему организму лучше их усваивать (12, 13, 14).
Например, цитрат кальция не требует желудочной кислоты для усвоения. Он также вызывает меньше побочных эффектов – таких как газы, вздутие живота или запор – чем другая форма, называемая карбонатом кальция (15, 16).
Таким образом, цитрат кальция является лучшим вариантом для людей с меньшим количеством желудочной кислоты, таких как пожилые люди.
Точно так же магний в цитратной форме усваивается более полно и является более биодоступным, чем оксид магния и сульфат магния (17, 18, 19).
Лимонная кислота также улучшает усвоение добавок цинка (20).
Может защитить от камней в почках
Лимонная кислота в форме цитрата калия предотвращает образование новых камней в почках и расщепляет уже сформированные (21, 22, 23).
Камни в почках – это твердые массы из кристаллов, которые обычно образуются в ваших почках.
Лимонная кислота защищает от образования камней в почках, делая вашу мочу менее благоприятной для образования камней (24).
Мочекаменную болезнь часто лечат лимонной кислотой, такой как цитрат калия. Однако стоит заметить, что потребление продуктов с высоким содержанием этой кислоты, таких как цитрусовые, может принести аналогичную пользу в предотвращении образования камней (3, 25).
Резюме:
Лимонная кислота помогает в энергетическом обмене, усвоении минералов и профилактике или лечении мочекаменной болезни.
Безопасность и потенциальный вред
Синтетическая лимонная кислота, признана FDA безопасной (5).
Никаких научных исследований, исследующих безопасность синтетической формы лимонной кислоты при потреблении в больших количествах в течение длительных периодов, не проводилось.
Тем не менее были сообщения о болезнях и аллергических реакциях на добавку.
В одном сообщении были обнаружены боли в суставах с отечностью и тугоподвижностью, боли в мышцах и животе, а также одышка у четырех человек после того, как они употребляли продукты, содержащие промышленную лимонную кислоту (4).
Что касается потребления природных форм лимонной кислоты, таких как лимоны и лаймы, то подобных побочных эффектов не наблюдалось при их употреблении.
Исследователи признали, что они не могли доказать, что синтетическая лимонная кислота была причиной этих симптомов, но порекомендовали дополнительно изучить ее использование в продуктах питания и напитках.
В любом случае, ученые предположили, что симптомы, скорее всего, были связаны с плесенью, используемой для производства лимонной кислоты, а не с самим соединением.
Резюме:
Небольшой отчет показывает, что остатки плесени от произведенной лимонной кислоты могут привести к аллергии и другим болезням, но это еще не доказано.
Подведем итог
- Лимонная кислота естественным образом содержится в цитрусовых фруктах, но в продукты питания, лекарства, добавки и чистящие средства обычно добавляются синтетические формы, полученные из плесени.
- Хотя остатки плесени в процессе производства могут в редких случаях вызывать аллергию, лимонная кислота обычно считается безопасной.
Поделиться новостью в соцсетях Метки: Лимонная кислота

 Следующая запись »
Следующая запись »Что вреднее для здоровья уксус или лимонная кислота?
Уксус и лимонная кислота – популярные специи, использующиеся не только в кулинарии, но и как чистящие или дезинфицирующие средства, но какая из них вреднее?
Уксус
Уксус – это прозрачная жидкость, являющаяся
Уксус бывает:
- Яблочным.
- Солодовым.
- Бальзамическим.
- Рисовым.
- Тростниковым.
- Винным.
- Ароматизированным.

Яблочный уксус
Яблочный уксус изготавливается из сидра, а используется как приправа для птицы или рыбы, маринад или подкислитель компотов из фруктов.
Солодовый уксус
Солодовый уксус готовится из перебродившего ячменного сусла. Такой уксус бывает:
- Дистиллированным.
- Светлым.
- Тёмным.
Бальзамический уксус
Бальзамический уксус очень терпкий, поэтому его используют в очень маленьких количествах. К примеру, им слегка сбрызгивают салаты, по капле добавляют в десерты, приготовленные из фруктов, а также в мороженое.
Рисовый уксус
Рисовый уксус бывает нескольких цветов:
- Красным.
- Чёрным.
- Белым.
Красным уксусом дополняют блюда, приготовленные с использованием морепродуктов. Белый уксус используется для заправки салатов, а чёрный отлично сочетается с мясными блюдами.
Тростниковый уксус произведён из перебродившего тростникового сиропа. Используется как дополнение к свинине, птице и рыбе в жареном либо тушёном виде.
Как отличное дополнение для заправок салатов, как маринад или даже как составляющее соусов может использоваться винный уксус, изготовленный из красного вина.
Ароматизированный уксус
Ароматизированный уксус изготавливается путём настаивания столового уксуса с различными пряностями на протяжении двух недель.
Лимонная кислота
Лимонная кислота – специя, или же порошок, использующаяся как средство для чистки чайников, стиральных машин, посуды, а также как ингредиент в приготовлении соусов, сыров, используется при консервации, в качестве барьера развитию вредоносных микроорганизмов, возникновению плесени, а также как усилитель вкуса.
В косметологии лимонная кислота применяется как компонент для изготовления шампуней, лосьонов, бомбочек для ванн, различных кремов и других продуктов для ухода за лицом и телом.
Врачи используют эту специю для приготовления лекарств, улучшающих обмен веществ в организме человека.
Не стоит забывать, что кислота содержится во многих ягодах, фруктах, а также и в самом организме человека.

Вред уксуса
Польза и применение уксуса широко известны, но мало кто знает о вреде этой жидкости.
- Яблочный уксус при похудении. Среди худеющих дам, ходят легенды, что яблочный уксус способствует быстрому снижению веса. Но никто не задумывается о том, что уксус очень сильно повышает уровень содержания кислоты в желудке. Поэтому он противопоказан при: язве; гастрите; панкреатите; любых других заболеваниях желудочно-кишечного тракта;
- Усиление мочеиспускания. Уксус является мочегонным средством, в связи с чем, он противопоказан при любых проблемах с печенью, а также при цистите.
- Ожоги. Важно помнить о том, что уксус – кислота. Слизистые оболочки наиболее подвержены воздействию у детей и людей пожилого возраста, поэтому им стоит исключить уксус в любом виде из своего рациона, взрослым стоит просто ограничить потребление.
- Вред для зубной эмали. Кислота, в большом количестве содержащаяся в уксусе, вредоносно влияет на зубную эмаль, то есть разрушает её. Во избежание плохих последствий, после каждого употребления, стоит полоскать ротовую полость водой. Вреда от уксуса гораздо меньше, чем пользы, поэтому отказываться от его потребления полностью не стоит.
Вред лимонной кислоты
- Вред для ЖКТ. Само название «лимонная кислота», уже говорит о высоком содержании кислоты, а это опасно для людей, страдающих любыми болезнями желудочно-кишечного тракта. Поэтому им стоит исключить лимонную кислоту из своего рациона.
- Ожоги слизистых оболочек. В этой сфере лимонная кислота наиболее опасна в виде порошка. Так же как и уксус, при попадании на слизистые оболочки человеческого организма она может нанести непоправимый вред.
- Разъедание зубной эмали. Из-за высокого содержания кислоты, при попадании в ротовую полость, начинается процесс разъедания зубной эмали. Поэтому потреблять лимонную кислоту, как и уксус, можно только в разбавленном виде и в небольших количествах, а после приёма внутрь, обязательно прополоскать рот.
Что же вреднее?
Возможный вред от потребления уксуса и лимонной кислоты примерно идентичен:
- Ожоги слизистых оболочек, из-за повышенного содержания кислоты.
- Нанесение вреда зубной эмали, так же из-за очень высокого количества кислоты в составе.
- Обострение болезней желудочно-кишечного тракта (ЖКТ), из-за той же кислоты.
То есть весь вред этих продуктов заключается в том, что их основа – кислота, а она достаточно агрессивна по отношению к организму человека. При попадании на кожу могут появиться раны, или даже язвы, а попадание в глаза может повлечь за собой необратимые последствия. Поэтому нужно не только с осторожностью потреблять уксус и лимонную кислоту, но и обращаться нужно тоже аккуратно. Однако следует помнить, что людям, имеющим:
- Язву.
- Гастрит.
- Панкреатит.
- Другие заболевания ЖКТ.
Однозначно стоит отказаться от потребления уксуса и лимонной кислоты, во избежание обострения заболеваний, они могут выразиться в увеличении болей, кашле или даже рвоте. Если же неприятные последствия всё-таки посетили, то стоит немедленно обратиться к врачу за квалифицированной помощью.
Отвечая на вопрос, что вреднее, уксус или лимонная кислота, можно ответить так: и то, и другое по-своему полезно и по-своему вредно. Но если знать меру в употреблении, то уксус и лимонная кислота принесут только пользу, например:
- Помогут законсервировать огурцы, помидоры и другие засолы.
- Станут отличным добавлением в салатные заправки.
- Послужат вкуснейшим маринадом.
- Станут отличным помощником для медиков и косметологов, дав им возможность создать новые препараты и косметику.
- При грамотном использовании, помогут безопасно снизить вес.
- Станут одним из ингредиентов плавленых сыров и соусов.
- Продезинфицируют любую поверхность.
- Помогут очистить стиральные машины, не хуже химических аналогов из масс маркетов.
- Очистят чайник от накипи.
Похожие материалы:
Лимонная кислота — Википедия
| Лимонная кислота | |
|---|---|
| ( {{{картинка}}})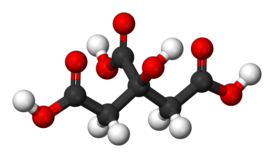 ( ({{{картинка3D}}}) | |
| Систематическое наименование | 2-гидроксипропан-1,2,3-трикарбоновая кислота |
| Традиционные названия | Лимонная кислота |
| Хим. формула | (HOOCCH2)2C(OH)COOH |
| Молярная масса | 192,1 г/моль |
| Плотность | 1,665 г/см³ |
| Температура | |
| • плавления | 153 °C |
| • разложения | 175 °C |
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 3,14[1] |
| Растворимость | |
| • в воде | 133 г/100 мл |
| Рег. номер CAS | 77-92-9 |
| PubChem | 311 |
| Рег. номер EINECS | 201-069-1 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E330 |
| RTECS | GE7350000 |
| ChEBI | 30769 |
| Номер ООН | 1789 |
| ChemSpider | 305 |
| Краткие характер. опасности (H) | |
| Меры предостор. (P) | P264, P280, P305+P351+P338, P337+P313 |
| Сигнальное слово | осторожно |
| Пиктограммы СГС |  |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Лимо́нная кислота́ (2-гидроксипропан-1,2,3-трикарбоновая кислота, 3-гидрокси-3-карбоксипентандиовая) HOOC-CH2-C(OH)COOH-CH2-COOH или (НООССН2)2С(ОН)СООН — трёхосновная карбоновая кислота.
Кристаллическое вещество белого цвета, температура плавления 153 °C. Хорошо растворима в воде, растворима в этиловом спирте, малорастворима в диэтиловом эфире. Является слабой кислотой. Соли и сложные эфиры лимонной кислоты называют цитратами.
Открытие лимонной кислоты приписывают арабскому алхимику Джабиру ибн Хайяну. Выделить её впервые удалось шведскому аптекарю Карлу Шееле. В 1784 году он осадил её в виде цитрата кальция из лимонного сока.
В 1838 году Юстус фон Либих установил, что в молекуле лимонной кислоты присутствует одна гидроксильная группа и три карбоксильные группы. Собственно лимонная кислота в чистом виде была получена из цитрата кальция в 1860 году в Англии[2][3].
Кристаллы лимонной кислоты под микроскопом между скрещённых поляроидов. Радужные цвета обусловлены разным вращением плоскости поляризации света для различных длин волн. Увеличение 200х.Лимонная кислота представляет собой кристаллическое вещество без цвета и запаха, имеющее сильный кислый вкус. Ниже 36,6 °С она кристаллизуется из водного раствора в виде моногидрата, который имеет плотность 1,542 г/см3 и плавится при 100 °С. Его кристаллы имеют орторомбическую сингонию. Безводная лимонная кислота имеет относительную плотность 1,665 г/см3и плавится при 153 °С.
Моногидрат кристаллизуется в моноклинной сингонии. Перевести моногидрат в безводную форму можно в вакууме в присутствии серной кислоты. В безводном виде гигроскопична и поглощает влагу из воздуха[4].
При нагревании выше 175 °C лимонная кислота переходит в аконитовую кислоту, а при сухой перегонке отщепляется вода и декарбоксилируется, одновременном образуя ацетон, и даёт ангидриды итаконовой и цитраконовой кислот. Окисление перманганатом калия при 35 °С приводит к ацетондикарбоновой кислоте, а при 85 °С — к щавелевой кислоте. При плавлении с гидроксидом калия лимонная кислота образует щавелевую кислоту и уксусную кислоту[5].
Лимонная кислота является слабой трёхосновной кислотой, образует три ряда солей, в растворе подвергается многоступенчатой электролитической диссоциации. Константы диссоциации (в воде при 18 °C) равны:
- К1 = 8,2⋅10−4;
- K2 = 1,8⋅10−5;
- K3 = 4,0⋅10−6[4].
В водном растворе лимонная кислота образует хелатные комплексы с ионами кальция, магния, меди, железа и другими. Иногда в комплексообразовании участвует не одна молекула лимонной кислоты[5].
Лимонная кислота образует сложные эфиры со спиртами в присутствии обычных кислотных катализаторов (серная кислота, пара-толуолсульфокислота, ионообменные смолы) либо без катализатора (с высококипящими спиртами). Некоторые эфиры, например, Триметилцитрат, триэтилцитрат и трибутилцитрат используются в качестве пластификаторов. С двухатомными и многоатомными спиртами лимонная кислота образует полиэфиры[6].
Гидроксильная группа лимонной кислоты при обработке хлорангидридами органических кислот и ангидридами кислот может участвовать в образовании сложных эфиров, а также взаимодействует с эпоксидами[6].
Лимонная кислота под действием УФ начинает испускать слабое зелёное свечение в течение короткого промежутка времени[источник не указан 207 дней].
В промышленности[править | править код]
С середины 1800-х гг. лимонную кислоту получали исключительно из сока недозревших лимонов, смешивая его с негашёной известью и осаждая таким образом плохорастворимый цитрат кальция. Обработка цитрата кальция серной кислотой приводит к образованию осадка сульфата кальция, а из надосадочной жидкости кристаллизацией выделяли лимонную кислоту. Выход такого процесса составлял 2-3 мас. % от массы фруктов[6]. В литературе упоминается, что лимонную кислоту в виде кальциевой соли развозили из Сицилии и Южной Италии к местам потребления (преимущественно в Англию, Францию и США), а саму кислоту выделяли уже на месте[7].
В 1893 году был обнаружен первый ферментативный метод получения лимонной кислоты: немецкий химик и миколог Карл Вемер использовал для этого плесневые грибы рода пеницилл. Однако внедрить метод в промышленность не удавалось из-за проблем с очисткой продукта. Успех был достигнут лишь в 1919 году, когда ферментативный процесс был организован в Бельгии. Перевес в пользу ферментативного получения произошёл после Первой мировой войны, когда возникли проблемы с поставкой лимонной кислоты из Италии, а мировые потребности всё более нарастали. В 1923 году фирма Пфайзер коммерциализировала открытый ранее Джеймсом Карри и Чарлзом Том процесс превращения углеводов в лимонную кислоту под действием плесневых грибов вида Aspergillus niger в присутствии небольшого количества неорганических солей[7].
По состоянию на начало ХХІ в. весь объём промышленной лимонной кислоты производится биосинтезом. В качестве сырья используют гидролизат кукурузы (в Северной и Южной Америке и Европе), гидролизат маниока, батата и кукурузы (в Азии), кристаллическую сахарозу (в Южной Америке) и мелассу (в Азии и Европе). В некоторых случаях лимонную кислоту получают из сельскохозяйственных отходов[6].
Этот процесс используется с 1930-х гг. Теоретически, из 100 кг сахарозы можно получить 123 кг моногидрата лимонной кислоты либо 112 кг безводной лимонной кислоты. Фактически выход ниже так как грибки потребляют часть сахарозы для собственного роста и дыхания. Реальный выход составляет от 60 до 85 % от теоретического. Ферментативный процесс можно проводить в трёх форматах:
- твердофазная ферментация;
- поверхностная ферментация;
- глубинная ферментация[8].
При твердофазной ферментации сырьё помещается в желоба́ и смачивается водой. При необходимости в воду добавляют питательные вещества, и затем туда помещают грибковую культуру. После окончания процесса лимонную кислоту вымывают водой, выделяют из раствора и очищают.
Поверхностную ферментацию проводят на специальных лотках, куда помещают субстрат и некоторые неорганические питательные вещества. pH среды регулируют в диапазоне 3-7 pH в зависимости от вида субстрата, затем проводят стерилизацию и устанавливают необходимую температуру. Затем на лотки наносят культуру грибков, которые размножается и покрывает всю поверхность субстрата, после чего начинается образование лимонной кислоты. По окончании процесса из жидкости выделяют лимонную кислоту.
Глубинная ферментация проводится в больших ёмкостях в два этапа. Сначала 10 % субстрата ферментируют в течение 1 дня в качестве затравки, после чего смесь добавляют в основную массу и ферментируют в течение 3-7 дней. Процесс проводится при постоянной продувки жидкости воздухом с помощью компрессора[8].
После ферментации жидкость фильтруют через мембрану и отделяют лимонную кислоту от белков и остаточных углеводов негашёной известью, экстракцией или хроматографией. По первому, наиболее распространённому способу, лимонная кислота осаждается в виде кальциевой соли, которую затем обрабатывают серной кислотой, получая нерастворимый гипс и раствор очищенной лимонной кислоты. Второй способ основан на использовании специфичного растворителя, в котором лимонная кислота растворяется лучше, чем примеси.
Хроматографическая очистка основана на использовании анионитов: лимонная кислота сорбируется на носителе, а затем вымывается из сорбента разбавленной серной кислотой[9].
После выделения проводят очистку. Для этого загрязнённую лимонную кислоту обрабатывают активированным углём для удаления окрашенных примесей, пропускают через слой ионообменных смол для удаления растворимых солей, фильтруют от нерастворимых примесей и кристаллизуют[8].
В 2012 году мировой объём производства лимонной кислоты составил приблизительно 1,6 млн тонн, из них примерно 0,8—0,9 млн тонн произведено в Китае. Около 70 % от общего производства используется в пищевой промышленности[8].
Лабораторный синтез[править | править код]
В классический лабораторном синтезе лимонной кислоты в качестве исходного вещества применяют ацетон, который бромируют по метильным группам, затем производят реакцию с циановодородом и гидролизуют[6].
Полный синтез[править | править код]
Впервые лимонную кислоту химическим синтезом получили Гримо (Grimaux) и Адам (Adam) в 1880 году. Исходным соединением в этом синтезе послужил глицерин. Первичные гидроксильные группы молекулы глицерина сначала замещали на атомы хлора, а затем на нитрильные группы, которые при гидролизе давали концевые карбоксильные группы. Вторичную же гидроксильную группу окисляли до кетогруппы, к которой затем присоединяли циановодород; полученный циангидрин также при гидролизе давал карбоксильную группу[10].
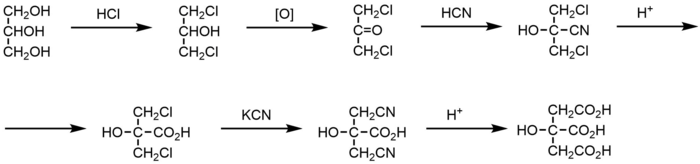
Другой подход был предложен в 1890 году. Он был основан на превращении ацетоуксусного эфира, который хлорировали, как предполагалось, по концевому α-положению, затем вводили в то же положение нитрильную группу, которую в итоге гидролизовали до карбоксильной группы. На последней стадии создавали заместители при атоме С2, получая циангидрин и гидролизуя его в кислой среде. Схема этого полного синтеза была подвергнута сомнению: некоторые химики, например, Шарль Прево, высказали предположение, что хлорируется не концевое α-положение ацетоуксусного эфира, а среднее, из-за чего образуется не сама лимонная кислота, а её изомер. Дискуссия, как предполагается, возникла из-за того, что в конце XIX в. ещё не существовало спектроскопических методов, которые позволили бы заметить эту разницу[11].

В 1891 году лимонную кислоту получили присоединением синильной кислоты к моноэтиловому эфиру ацетондикарбоновой кислоты с последующим гидролизом. Правда, само исходное вещество было изначально получено из лимонной кислоты[12].

В 1897 году был предложен подход к синтезу лимонной кислоты, основанный на недавно открытой реакции Реформатского (1895). Согласно этому методу, в реакцию вводились этилбромацетат и диэтилоксалоацетат в присутствии цинка[13].

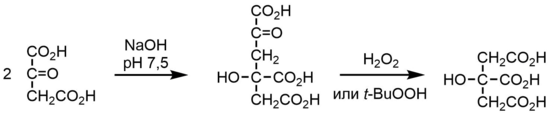
Из более поздних подходов можно отметить предложенное в 1973 году превращение щавелевоуксусной кислоты, которая при самоконденсации с декарбоксилированием давала цитроилмуравьиную кислоту. Последнюю затем в присутствии пероксида водорода или трет-бутилгидропероксида превращали в лимонную кислоту[14][15].
В 1980 году лимонную кислоту получили по реакции конденсации 3-метилбутен-3-ола-1 и формальдегида с последующим окислением полученного продукта диоксидом азота[16][15].

Лимонная кислота содержится в различных фруктах, в большом количестве — в цитрусовых (примерно до 5 % в плодах и до 9 % в соке). В 100 г лайма содержится 7 г лимонной кислоты; лимона — 5,6 г; малины — 2,5 г; чёрной смородины — 1,2 г; помидоров — 1,0 г; ананаса и клубники — 0,6 г; клюквы — 0,2 г; яблока — 14 мг[3].
Лимонная кислота участвует в цикле трикарбоновых кислот — основном процессе дыхания клетки, поэтому в некоторой заметной концентрации она содержится в организме всех животных и растениях[3].
Сама кислота, как и её соли (цитрат натрия, цитрат калия, цитрат кальция, дицитрат трикалия висмута), широко используется как вкусовая добавка, регулятор кислотности и консервант в пищевой промышленности (пищевые добавки E330—Е333), в производстве плавленых сыров, напитков, сухих смесей для приготовления шипучих напитков.
Применяется в медицине, в том числе в составе средств, улучшающих энергетический обмен в цикле Кребса. При приёме внутрь в небольших дозах, например, при употреблении плодов цитрусовых активирует цикл Кребса в организме, что способствует ускорению метаболизма.
В косметике используется как регулятор кислотности косметических средств, в качестве буферных растворов, хелатирующий агент, в смесях для приготовления «шипучих» ванн.
В нефтяной добыче при бурении нефтяных и газовых скважин используется для снижения pH бурового раствора после щелочных ванн.
В строительстве лимонную кислоту применяют в качестве добавки к цементному и гипсовому растворам для замедления схватывания[17][18].
Лимонная кислота может использоваться для травления слоя меди на печатных платах[19] в смеси с перекисью водорода.
Широко используется в бытовой химии в качестве очистительного средства нагревательных поверхностей, например, от накипи на дне чайника.
В конце 1970-х годов в Западной Европе получила распространение мистификация, известная как «вильжюифский список», в котором лимонная кислота была названа сильным канцерогеном[20]. В действительности же, при пищевом применении лимонная кислота считается безопасной добавкой.
Согласно европейскому законодательству, лимонную кислоту можно использовать в GMP без ограничений. Американская FDA определяет лимонную кислоту как GRAS (англ. generally recognized as safe и признаётся безопасной)[21].
Сухая лимонная кислота и её концентрированные растворы при попадании в глаза вызывают сильное раздражение, при контакте с кожей возможно слабое раздражение. При единовременном употреблении внутрь больших количеств лимонной кислоты возможны раздражение слизистой оболочки желудка, кашель, боль, кровавая рвота. При вдыхании пыли сухой лимонной кислоты — раздражение дыхательных путей[22].
LD50 для крыс перорально: 3 г/кг.
- ↑ Weast R. C. CRC Handbook of Chemistry and Physics (1st student edition) / R. C. Weast — 1 — CRC Press, 1988. — ISBN 978-0-8493-0740-9
- ↑ Apelblat, 2014, p. 1.
- ↑ 1 2 3 Ullmann, 2014, p. 1.
- ↑ 1 2 Ullmann, 2014, p. 2.
- ↑ 1 2 Ullmann, 2014, p. 3.
- ↑ 1 2 3 4 5 Ullmann, 2014, p. 4.
- ↑ 1 2 Apelblat, 2014, p. 2.
- ↑ 1 2 3 4 Ullmann, 2014, p. 4–6.
- ↑ Ullmann, 2014, p. 6–7.
- ↑ Apelblat, 2014, p. 213.
- ↑ Apelblat, 2014, p. 214–215.
- ↑ Apelblat, 2014, p. 216.
- ↑ Apelblat, 2014, p. 215.
- ↑ Wiley R. H., Kim K. S. Bimolecular decarboxylative self-condensation of oxaloacetic acid to citrolyformic acid and its conversion by oxidative decarboxylation to citric acid : [англ.] // J. Org. Chem.. — 1973. — Vol. 38, no. 20. — P. 3582–3585. — DOI:10.1021/jo00960a030.
- ↑ 1 2 Apelblat, 2014, p. 216–217.
- ↑ Wilkes J. B., Wall R. G. Reaction of dinitrogen tetraoxide with hydrophilic olefins: synthesis of citric and 2-hydroxy-2-methylbutanedioic acids : [англ.] // J. Org. Chem.. — 1980. — Vol. 45, no. 2. — P. 247–250. — DOI:10.1021/jo01290a008.
- ↑ Singh, N.B.; A.K. Singh, S. Prabha Singh. Effect of citric acid on the hydration of portland cement (англ.) // Cement and Concrete Research : journal. — 1986. — Vol. 16, no. 6. — P. 911—920. — ISSN 00088846. — DOI:10.1016/0008-8846(86)90015-3.
- ↑ Козлова В. К., Карпова Ю. В., Вольф А. В. Оценка эффективности добавок, замедляющих схватывание цементного теста // Ползуновский вестник. — 2006. — Вып. №2—2. — С. 230—233.
- ↑ РадиоКот :: Безопасный общедоступный состав для травления меди в домашних условиях
- ↑ https://www.jstor.org/pss/2749354
- ↑ Ullmann, 2014, p. 8.
- ↑ Merck Safety Data Sheet — Citric acid (pdf)
Опасна ли пищевая добавка Е330 для здоровья
В пищевой промышленности используются химические вещества для улучшения внешнего вида, аромата продукции и продления ее срока годности. Одна из таких – пищевая добавка Е330. Опасна ли она для здоровья человека, разберемся в статье.
Содержание:
Что такое пищевая добавка E330
В составе Е330 – лимонная кислота. Это органический антиоксидант, который используется в пищевой и технической области. Представляет собой белые микрокристаллы, которые хорошо растворяются в воде и спирте. Вкус – кислый.
В естественной среде содержится в растениях. В лимоне ее доля – 40 мг/100 мг. Намного больше в шиповнике – 470 мг/100 мг. Присутствует и в сладком перце, цитрусовых, клюкве, хвое.
Первоначально для ее создания применялись неспелые лимоны. В них содержится наиболее высокая концентрация кислоты. Сок фруктов смешивался с негашеной известью. Полученный цитрат кальция, попадая под воздействие серной кислоты, выделял сульфат кальция. Из жидкости этого вещества уже получали конечный продукт – лимонную кислоту.
Для ее производства в промышленных масштабах растения, сложные химические этапы не используются. Для удешевления и увеличения выпускаемой добавки применяется синтез сахара, крахмала и грибка плесени «Aspergillus niger». Полученная жидкость содержит 90% лимонной кислоты. После этого она проходит 5 этапов:
- Очищение от примесей.
- Упаривание.
- Кристаллизация.
- Сушка.
- Расфасовка.
Полученная пищевая добавка из-за химического биосинтеза и последующих этапов относится к ненатуральным продуктам.

Применение Е330
Вещество Е 330 чаще всего используется в пищевой промышленности. Выступает в качестве:
- антиоксиданта – препятствует окислению;
- консерванта – продлевает срок годности;
- стабилизатора – улучшает консистенцию;
- усилителя вкуса – делает его более насыщенным и приятным;
- регулятора кислотности – контролирует уровень кислоты.
E330 хорошо взаимодействует с другими пищевыми добавками. При смешении с E500 (содой) вещества выступают в качестве разрыхлителя теста, делая его более пышным.
Встречается в следующих продуктах питания:
- кондитерских изделиях;
- соках и газированных напитках;
- хлебобулочной продукции;
- консервированных овощах и фруктах;
- мясных и рыбных продуктах;
- сырных изделиях.
Список продуктов, в которых может использоваться E330, регулируется ГОСТ 31726–2012. Содержит около 70 наименований.
Кроме пищевой промышленности вещество активно применяется в косметологии. Входит в состав пилингов, очищающих средств. Обладает антибактериальными свойствами. Другие области – фармакология и бытовая химия.

Вред добавки
Натуральная лимонная кислота во фруктах хорошо усваивается организмом человека, придавая ему энергию. Такого эффекта нет у вещества, полученного путем химического синтеза. В России входит в список разрешенных веществ и считается безопасной для здоровья. Поэтому она используется в большинстве покупной продукции.
Вред связан с высоким уровнем ее концентрации в продуктах и частоте употребления. Специалисты выделяют следующие негативные последствия добавки:
- разрушение зубной эмали и появление кариеса;
- повышение чувствительности зубов;
- ожог желудка, симптомами которого являются сильные боли, рвота с кровью и кашель;
- развитие заболеваний желудочно-кишечного тракта: язва, панкреатит, гастрит, холецистит;
- появление рака (при потреблении в больших количествах).
Добавка Е330 в пищевых изделиях взаимодействует с другими вредными веществами, что делает такие продукты питания ненатуральными и нежелательными к употреблению.
Лимонную кислоту часто используют в домашних условиях для приготовления кондитерских изделий и напитков. При прямом контакте с добавкой нужно быть крайне осторожным, не забывая соблюдать правила безопасности. Она опасна при попадании концентрата на кожу – возможен ожог. При контакте с глазами есть вероятность потери зрения. Если она все-таки попала в глаза или на слизистые, то следует ополоснуть их водой и немедленно обратиться к врачу.

Польза лимонной кислоты
У лимонной кислоты есть плюсы. К ним относятся:
- укрепление иммунной системы;
- вывод вредных токсинов из организма;
- обновление клеток.
Польза от вещества проявляется наилучшем образом в натуральных фруктах и овощах, которые не содержат опасные примеси. Но даже после цитрусовых рекомендуется ополаскивать рот водой, смывая кислоту с зубной эмали.
Пищевая добавка E330 применяется в большом количестве разнообразной продукции, так как исполняет роль антиоксиданта, консерванта, стабилизатора, усилителя вкуса и регулятора кислотности. При частом употреблении изделий с лимонной кислотой происходит пагубное влияние на здоровье человека. Появляются заболевания полости рта и желудка. Чтобы получить всю пользу от нее, нужно вводить в рацион натуральные овощи и фрукты.
Посмотрите интересное видео про 5 способов использования лимонной кислоты:
